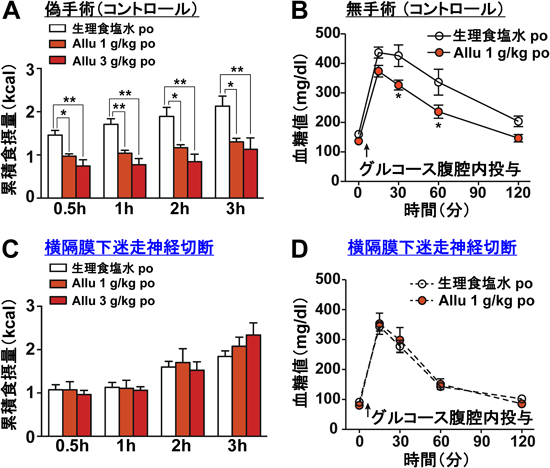
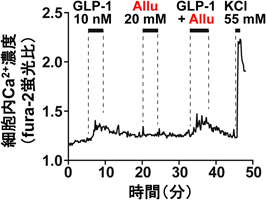
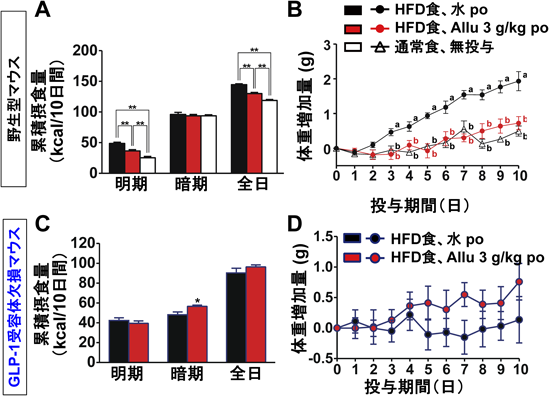
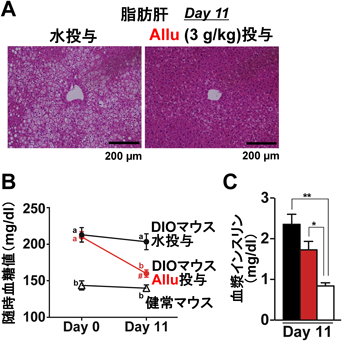
希少糖アルロースによる過食・肥満・糖尿病の改善:GLP-1と求心性迷走神経の役割Rare sugar D-Allulose ameliorates hyperphagia, obesity and diabetes: role of GLP-1 and vagal afferent
1 関西電力医学研究所統合生理学研究センター統合生理学研究部Director, Center for Integrative Physiology, Kansai Electric Power Medical Research Institute ◇ 650–0047 神戸市中央区港島南町1–5–6 神戸バイオテクノロジー・人材育成研究センター3F ◇ Kobe Biotechnology Research and Hume Resource Development Center 3F 1–5–6 Minatojimaminamimachi, Chuou-ku, Kobe 650–0047, Japan
2 神戸大学大学院医学研究科システム生理学 ◇ 650–0017 神戸市中央区楠町7–5–1 ◇ Kusunokicho 7–5–1, Chuou-ku, Kobe 650–0017, Japan
3 京都府立大学大学院生命環境科学研究科動物機能学Graduate School of Life and Environmental Sciences, Kyoto Prefectural University ◇ 606–8522 京都市左京区下鴨半町1–5 ◇ 1–5 Shimogamohangi-cho, Sakyo-ku, Kyoto 606–8522, Japan