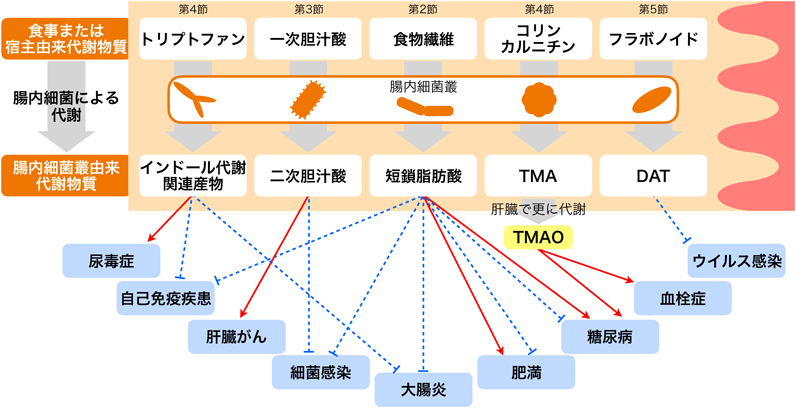
腸内細菌叢由来代謝物質がもたらす生体恒常性と疾患The impact of gut microbiota-derived metabolites in health and disease
1 株式会社メタジェンMetabologenomics, Inc. ◇ 〒997–0052 山形県鶴岡市覚岸寺字水上246–2 ◇ 246–2 Mizukami, Kakuganji, Tsuruoka, Yamagata 997–0052, Japan
2 慶應義塾大学先端生命科学研究所Institute for Advanced Biosciences, Keio University ◇ 〒997‒0052 山形県鶴岡市覚岸寺字水上246‒2 ◇ 246–2 Mizukami, Kakuganji, Tsuruoka, Yamagata 997–0052, Japan
3 JSTさきがけPRESTO, Japan Science and Technology Agency ◇ 〒332–0012 埼玉県川口市本町4–1–8 ◇ 4–1–8 Honcho Kawaguchi, Saitama 332–0012, Japan
4 筑波大学医学医療系Faculty of Medicine, University of Tsukuba ◇ 〒305–8575 茨城県つくば市天王台1–1–1 ◇ 1–1–1 Tennodai, Tsukuba, Ibaraki 305–8575, Japan
5 神奈川県立産業技術総合研究所Kanagawa Institute of Industrial Science and Technology ◇ 〒210–0821 神奈川県川崎市川崎区殿町3–25–13 ◇ 3–25–13 Tonomachi, Kawasaki-ku, Kawasaki, Kanagawa 210–0821, Japan