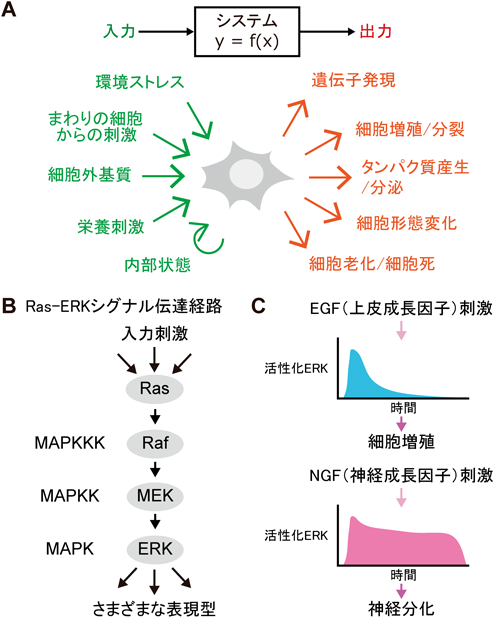
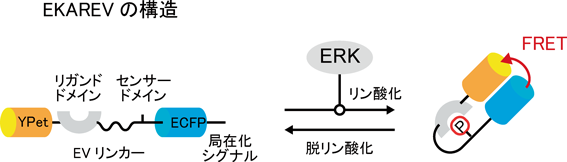
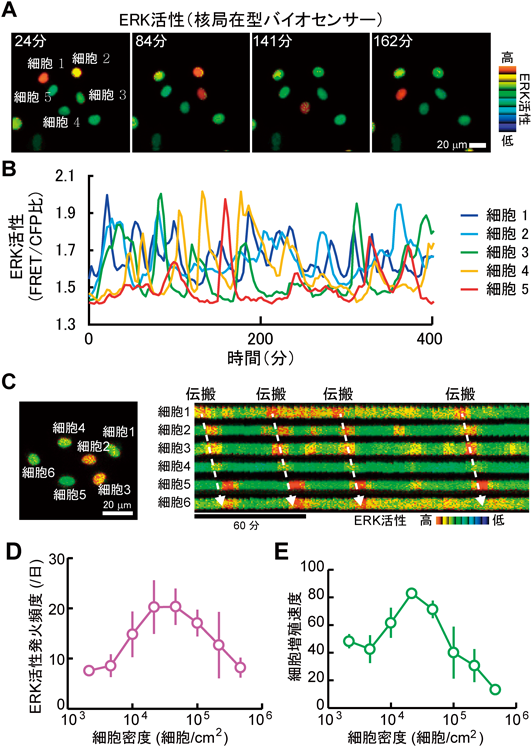
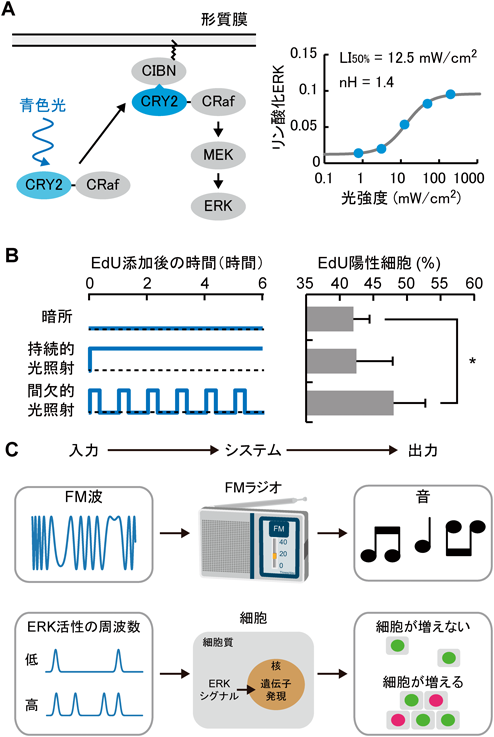
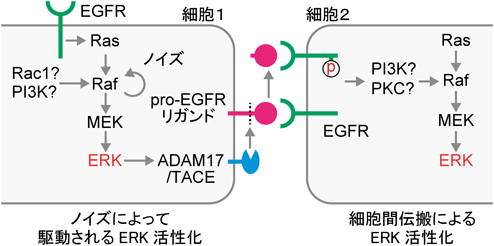
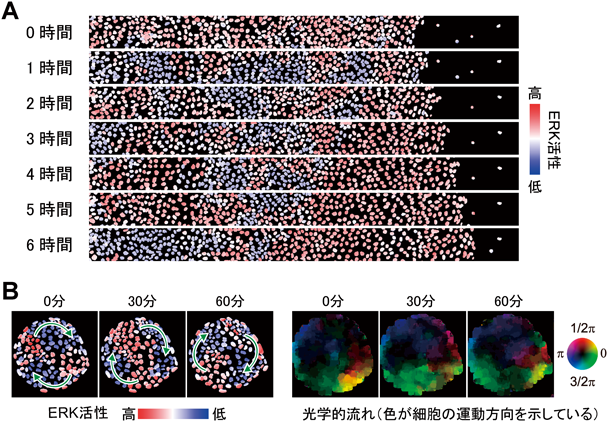
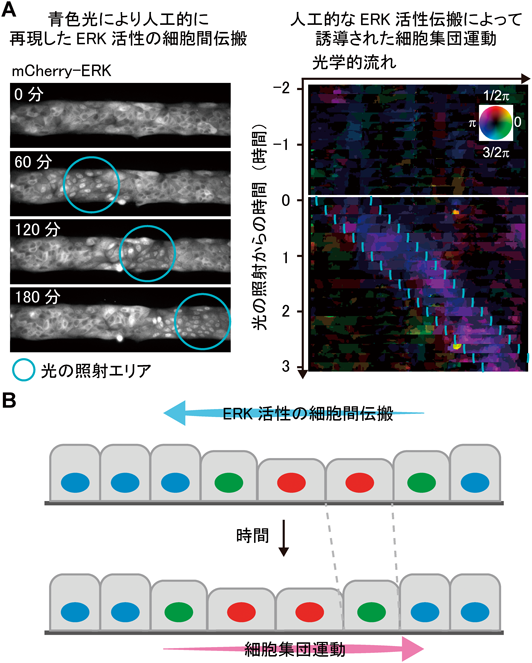
ERK MAPキナーゼによる細胞増殖と細胞集団運動の制御Regulation of cell proliferation and collective cell migration by ERK MAP kinase
自然科学研究機構生命創成探究センター定量生物学研究グループ/基礎生物学研究所定量生物学研究部門Quantitaive Biology Group, Exploratory Research Center on Life and Living Systems (ExCELLS)/Division of Quantitative Biology, National Institute for Basic Biology, National Institutes of Natural Sciences ◇ 〒444–8787 愛知県岡崎市明大寺町字東山5–1 ◇ 5–1 Higashiyama, Myodaiji, Okazaki, Aichi 444–8787, Japan