健康で長寿,というのは多くの人々の願いである.近年の医学の発展によりわが国の平均寿命は年々伸びているものの,がん・認知症などのさまざまな老化関連疾患や,加齢に伴う身体・脳機能の低下によって健康を維持したまま天寿を全うするのは大変難しいのが現状である.これからの超高齢社会において健康・長寿を実現していくためには,老化や疾患が生じるメカニズムを包括的に解明し,それらを予防・制御する方策を立てることが必要である1–4).
老化および生活習慣病の原因としてこれまでは酸化ストレス説が提案されている1, 3).酸化ストレス説とは,活性酸素種による細胞内高分子への酸化ダメージの蓄積が,加齢に伴う種々の機能障害の原因であると考えるものである.この細胞内高分子の酸化ダメージとして,脂質過酸化・タンパク質カルボニル化・DNA酸化損傷を測定して,酸化ストレスを評価するのが一般的であるが1–3),DNA損傷機構に関しては現在でも不明な点が多い5, 6).
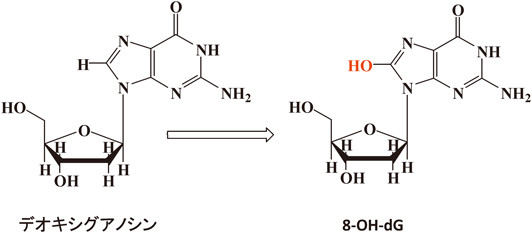
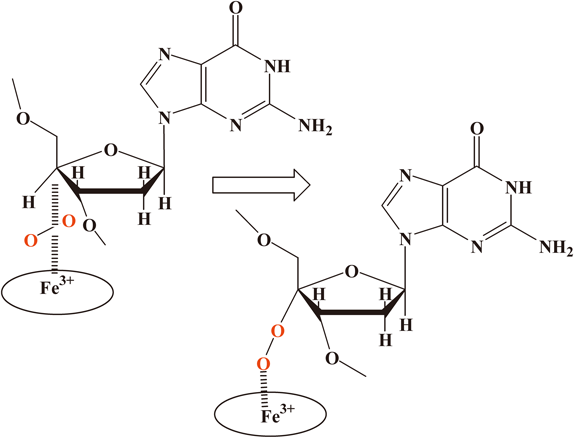
ここでは例として8-ヒドロキシデオキシグアノシン(8-OH-dG)を取り上げてみよう.Fe-(nta)溶液[(nta)については図1参照]を動物に腹腔内投与を行うと100%がんを生じるが7),そのとき体内に異常な量の8-OH-dG(スキームI)が観測されることから,この8-OH-dGががん化を評価する重要な指標とされている8–10).また,8-OH-dGはアルツハイマー病・パーキンソン病患者の脳でも大量に検出されていることからも,がんや脳の老化のバイオマーカーとして注目されている化合物である.デオキシグアノシンは,DNAの構成成分の一つであるので,酸化ストレスで,DNAから遊離し,それが8-OH-dGに変化していると考えられる10).
さて,この8-OH-dGは従来の認識によれば,デオキシグアノシンと活性酸素種の一種であるヒドロキシルラジカル(OH·)との反応で生成するとされており,どの教科書にもそのように記載されている(スキームI参照)3).
問題は,ここで活性酸素種としてあげられているヒドロキシルラジカル(OH·)である.これはかなり前から,Fenton反応によって,以下の化学式で形成するとされている(式1). この式が発表されてから1世紀も経っているが,この式に何も批判が出ないというのは,錯体化学の知識がこの分野ではまったく普及していないためと思われる.ここであらためて,この問題について言及する.
(式1)で示されている,Fe2+という化合物は,非常に特殊な条件下でないと存在しない.これは多分に(たとえば硫酸第一鉄塩を)水に溶かした状態を指していると思われるが,だとしたら,[Fe(H2O)6]2+と書かねばならない(式2参照).2価鉄イオンの周辺に6個の水分子が結合している状態で,これはFe2+とはまったく違う.ただ,(式2)の反応は実験室系では成立するかもしれないが,生体内では起こりえない.
生体の体液中にはキレートと呼ばれる多くの化合物が存在する.代表例はクエン酸,アミノ酸,分子量がいろいろなペプチド,高分子タンパク質などで,これらは金属イオンと強く結合する性格を持つ(錯体化学ではこれをキレート効果と呼んでいる).一例を述べると,以下のようになる.
このため,生体中では[Fe(H2O)6]2+イオンはほとんど存在しないことになるが,これは広く認められている事実である11).そうすると,生体中でのFenton反応とは一体どのように起こっているのかということになるが,これまでこの問題は一切議論されずに,2価鉄イオンと過酸化水素との反応でヒドロキシルラジカルが生成すると盲信されている.
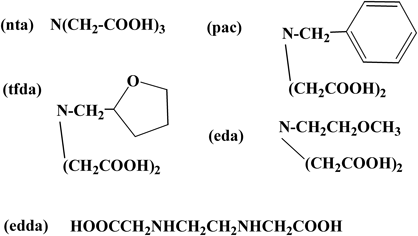
このような事情から,生体中ではFenton反応の結果が適用できるとは考えにくく4),8-OH-dGの生成にはヒドロキシルラジカルは関与していないと考えている.我々は,Fe-(nta)溶液を動物に腹腔内投与を行うと体内に8-OH-dGの異常な増大が観測される事実から,この種の錯体に関する研究を行った.使用した配位子系を図1に示す.
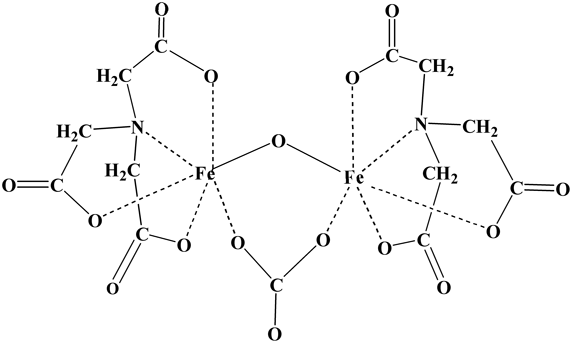
Fe-(nta)錯体は溶液中では,オキソ・カルボナト架橋二核鉄(III)錯体であることが構造解析から明らかにされている(図2)12).図1に示した4座配位子(pac, edda, tfda, eda)などもすべて,溶液中の構造はオキソ・カルボナト二核錯体であることが,構造解析,吸収スペクトルから明らかにされている13).
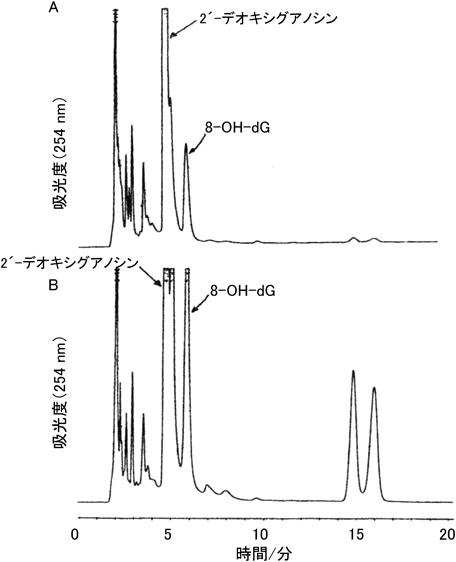
我々は,いくつかの二核鉄(III)錯体と過酸化水素との混合物がデオキシグアノシンとの反応で大量の8-OH-dGを与えることを見いだしている.一例として(tfda)錯体の例を示した(図3)14).この8-OH-dGの形成はキレート構造に依存し,その活性度はnta>tfda>edda, eda>>pacとなり,まったく生成しない系(pac)もある.このオーダーは,実はこれらの鉄キレートを動物に投与したときの腎毒性の順序nta>edda>>pacとも一致している4, 7).このキレート構造による違いは,鉄(III)イオンと過酸化水素の結合様式の違いによると指摘されている4)が,注目すべきは,鉄イオンさえあれば,8-OH-dGが生成するというものではないということである.
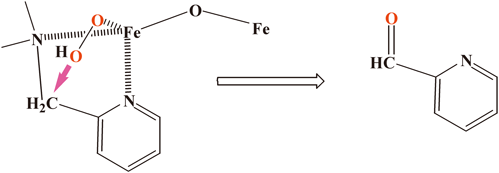
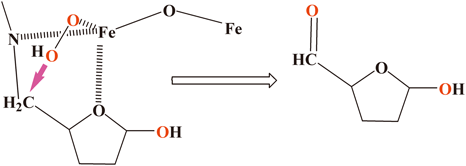
まず,過酸化水素が鉄(III)イオンと結合するところから考えよう.Fe-(nta)溶液に過酸化水素を加えると,二核錯体(図2参照)のカルボナトイオンが脱離し,その空いた場所へ過酸化水素の酸素原子が結合する.その結合様式には2通りある.一つ目の結合様式を(pac)錯体で示すと,二核鉄錯体(図2参照)の2個の鉄イオンのうち,(pac)配位子が結合している鉄イオンに酸素原子が結合(スキームII).この場合は,ペルオキシドイオンの酸素原子に配位した(pac)の-CH2-N-結合の炭素原子への攻撃(スキームII参照;攻撃の推進力については後述)が起き,O–O結合の開裂反応,–C–N結合の切断を経て,最終的に–CH(=O)になる.このときの生成物,ピリジン-2-アルデヒドは検出されている14).
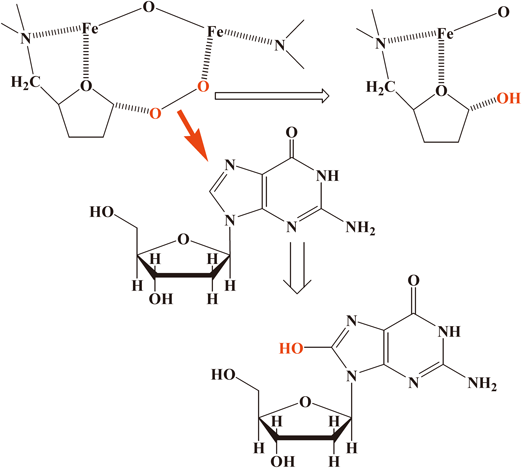
2番目の結合様式は(pac)錯体では生じないが,Fe-(tfda)錯体,Fe-(eda)錯体で可能になるケースである.二核鉄構造の鉄イオンと結合した過酸化水素が別の鉄イオンと結合しているテトラヒドロフラン骨格の炭素原子と結合する(スキームIII).このテトラヒドロフラン骨格とペルオキシドイオンとの結合については,広く実証されている15, 16).このように結合したペルオキシドイオンがデオキシグアノシンの8位炭素原子を攻撃し,O–O結合の開裂反応を伴って8-OH-dGを与えると考えている(スキームIII,右下の反応).このとき,テトラヒドロフラン骨格と結合している過酸化水素の酸素原子が,テトラヒドロフラン核に移動する反応も起きる(スキームIII,右上).この場合はさらに(pac)錯体で指摘された–CH2–N–結合とペルオキシドイオンとの反応(スキームII)が起きると予想されるが,実際にスキームIVの化合物は反応溶液中で検出されている(図3の~15分のところに観測されるピークがこれと関連する)14).
上の考えを支持する事実を加えよう.図3ではデオキシグアノシンを取り上げたが,グアノシン以外の核酸塩基(たとえばアデニン,チミン)などでも実験を行っており,それらの塩基では水酸化反応はまったく進行しない.計算によれば,デオキシグアノシンの8位が一番酸化されやすいことは明らかになっている17)が,ヒドロキシルラジカルは,他の塩基も酸化できることが確認されているので14),生体中での8-OH-dGの形成は,ヒドロキシルラジカルではなく,スキームIIIで述べたように鉄(III)-ペルオキシド付加体による炭素原子への攻撃で生成していると考えるのが最も妥当と考えている.
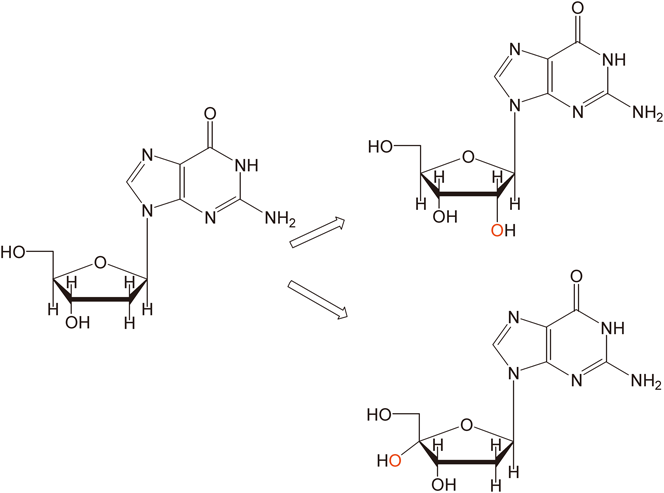
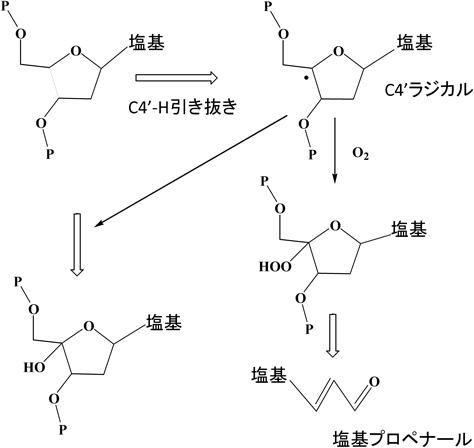
同様な反応を(eda)錯体でみると,非常に興味深い結果が得られている14).この場合はペルオキシドイオンと配位子(eda)のメチル基の炭素原子との相互作用が推定されているが,その妥当性は多くの事実から支持されている15, 16).この錯体の場合,生成物は8-OH-dGよりも,用いたデオキシグアノシンの2′位と4′位の水酸化反応が進行していることが明らかになった(スキームV,右下)14).特に4′位の水酸化反応はブレオマイシン(bleomycin)によるDNA損傷機構を理解する上で非常に重要である(後述).
さて,これらの実験結果から,DNA損傷に関する重大な知見が得られる.それは,この二核鉄(III)-ペルオキシド付加体は生体中で生成可能であることから,Fenton反応(すなわちヒドロキシルラジカル)を考えなくとも8-OH-dGの形成を明白に説明できるということである.Fe-(pac)錯体は8-OH-dGの形成にはまったく効力を示さないが,スキームIIで示された反応を起こしていることが明らかになっている.これは,鉄(III)イオンに結合したペルオキシドイオンが配位子系(pac)と反応してC–N結合切断を行うことを示し,この切断により鉄(III)-ブレオマイシン-ペルオキシド付加体は,ブレオマイシンやDNA鎖の切断反応・水酸化反応を誘導できることがわかるが,このような反応がなぜ起きるのかは,これまで明らかにされてこなかった.これらの反応機構については3節で詳しく論じたい.
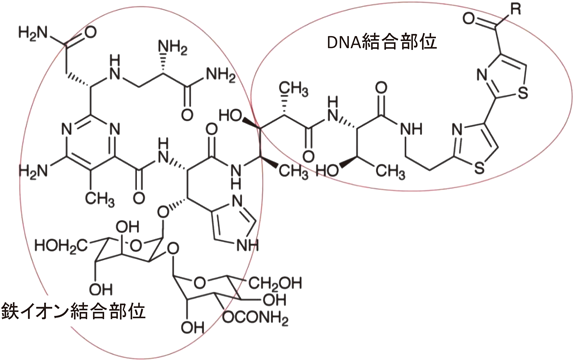
ブレオマイシン(図4)は梅沢博士によって発見された水溶性の糖ペプチド抗生物質18)で,通常は培養液から銅(II)錯体として得られる.ブレオマイシンは抗酸菌などの細菌に対して抗菌作用を示すと同時にいくつかの動物の移植がんに対して制がん作用を示す.現在,ヒトの皮膚,頭頸部,子宮頸部などの扁平上皮がんや悪性リンパ種に対する優れた化学療法剤として,臨床医学で利用されている5, 6).
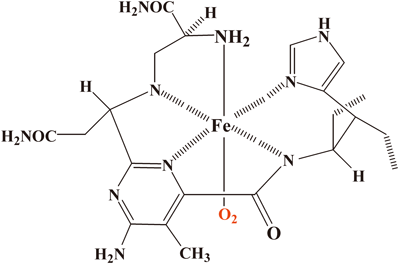
実験では,鉄(II)イオンとブレオマイシン(以下BLM)を酸素下で混合する5, 6)と鉄(II)-BLM-O2錯体(図5)を形成し,さらに1電子を得て,活性BLM(activated BLM)となるが,それはFe(III)-BLM-ペルオキシド錯体であることが確かめられている6).この溶液とDNAを混合するとDNAの切断反応が観測されるが,要点をまとめると図6のようになる.DNA切断様式には2通りあり,4-OH誘導体を形成(左側)する場合と,最終的に塩基プロペナール(propenal)形成を伴う(右側)場合とがある.無酸素下では塩基プロペナールの形成は観測されず,塩基プロペナール形成は,酸素と4′位のラジカルとの反応で生成する4′-OOHの形成を介して行われると指摘されており5, 6),いずれにしても活性BLMとDNAとの反応では,まず4′位の炭素ラジカル形成が必須であることが指摘されている.
活性BLMによるDNA切断反応は,図6で示された様式で起きることがStubbeらによって提唱され,疑いもなく信用されてきているが,なぜ活性BLMがDNAを切断・損傷できるのかをきちんと説明するためには同族体のコバルト(III)錯体に関するデータと一緒に議論する必要があるが,これがなされていないことが問題であった.
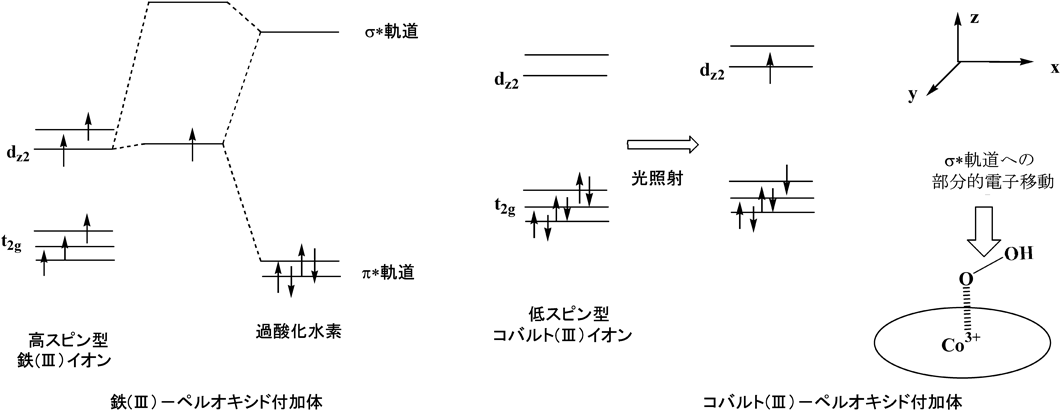
BLM-コバルト(III)-ペルオキシド付加体とDNAとの複合体の構造はすでに明らかにされているが19),興味深いことに,このBLM-コバルト(III)-ペルオキシド付加体はDNAとは反応しない(ペルオキシドイオンと4′位の炭素原子とは非常に近いにもかかわらず).そして,紫外線照射を受けて初めてDNA切断反応が進行する(single-stranded開裂)ことがわかっている17).この鉄(III)-BLM錯体とコバルト(III)-BLM錯体の反応性の違いを説明するには分子軌道法に従った考察が必須である.スキームVIの左側に,鉄(III)-ペルオキシド付加体の分子軌道の一部を示した.ここで鉄イオンのdz2軌道が,ペルオキシドイオンのπ*軌道(2電子が充填されている)とσ*軌道(電子は充填されていない)と同時に相互作用できる点に注目されたい20, 21).
高スピン型鉄(III)イオンのdz2軌道には1個のd電子が充填されているが,コバルト(III)錯体(低スピン型)ではこの軌道には電子が充填されていないことが重要である(スキームVI,右側).これは,分子軌道形成によりペルオキシドイオンのσ*軌道への金属イオンからの電子の流れ込みが鉄(III)錯体では起きるが,コバルト(III)錯体では起きないことを示している.
コバルト(III)錯体では,紫外線照射を受けて初めてDNA切断反応が進行するが,この紫外線照射とは実は,コバルト(III)錯体のt2 g軌道からeg(dz2)軌道への遷移に相当するのである(スキームVI,右側).ここが非常に重要で,この紫外線照射で,鉄(III)イオンとコバルト(III)イオンにそれぞれ結合しているペルオキシドイオンの電子状態が同じになる(dz2軌道には1個のd電子が充填されること).この状態になって初めて,コバルト(III)イオンからペルオキシドイオンのσ*軌道への電子の流れ込みが起きるが,これにもともとあった近傍のDNA分子の炭素原子からの電子の流れ込みとが重なって,ペルオキシドイオンのheterolytic cleavage,21–25)が誘導され,切断されたO–O分子の1個の酸素原子がDNA分子の炭素原子へ移動し,これによりコバルト(III)-BLM-ペルオキシド付加体による4′位の水酸化反応が起きるのである(構造解析の結果もこれと一致する19)).活性BLMでは,そのままで鉄イオンとDNA分子からのペルオキシドイオンのσ*軌道への電子の流れ込みが起きるので,上の議論から活性BLMによってDNAの損傷反応(水酸化反応)が進行することが理解でき,かつ,すでに示したスキームII~Vでみられたペルオキシド付加体による反応の本質が明らかにされたことになる.ここで述べたペルオキシドイオンのO–O結合のheterolytic cleavageは,ラジカル反応とは無関係であり(脚注参照)22–24),DNA切断の最初のスタートが4′位のラジカル形成とするStubbeらの説とは相いれないものである.このペルオキシド付加体のO–O結合のheterolytic cleavageの重要性は初め,NishidaによってチトクロムP450の反応機構を解明するのに提唱され22–24),多くの実験結果から支持されており24, 25),さらにコバルト(III)-BLM-OOHの反応機構に対する計算結果26)からもその考えの正当性が支持されている.
3節での議論により活性BLMによってsingle-stranded切断(ss切断)が進行する理由が明らかにされたが,double-stranded切断(ds切断)が進行する理由は明らかになってはいない.Stubbeらは,図6右側の塩基プロペナールの生成経路が進行するためには酸素分子が必要と述べているが,酸素下であっても,この反応はコバルト(III)-BLMでは進行しない.これは鉄(III)イオンとコバルト(III)イオンの錯体としての違いが原因である(後述).
実は,鉄(III)錯体に関してNishidaらによって初めて発見された奇妙な反応が知られている.それは,鉄(III)イオンはある条件下で酸素分子と容易に反応するというものである27, 28).これはいくつかの例で実証されており,今の例でいうと,BLM-鉄(III)キレートの存在下,DNAと酸素分子との相互作用が進行し,DNA過酸化物(図6,右側の4′-OOHに相当する,後述)が形成され,それがBLM-鉄(III)キレートと結合し(スキームVII参照),DNA過酸化物のO–O結合のheterolytic cleavage22, 25)を経てDNAの水酸化反応が進行する結果,ds切断を誘導していると考えている.
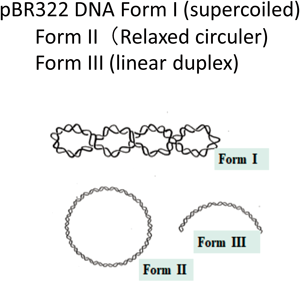
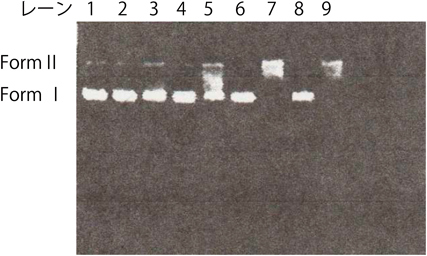
スキームVIIで仮定されている反応が生じることは,実際に鉄(III)-BLMが過酸化水素なしでもDNA切断を行うという我々の実験結果から支持されている29).ここではDNAとしてsupercoiled DNA(スキームVIII)を使用した.このDNAは,1か所の切断でForm IIへ移行し,2か所の切断でForm IIIへ移行する.実験では,DNAと種々の濃度のFe-BLM·A2溶液を混合し,一定時間後電気泳動を行い,その様子を観察した.図7に示したように,Fe-BLM·A2は,過酸化水素が存在しなくてもDNAを容易に切断する(Form II, Form IIIの形成,レーン5, 7, 9に注目;Form IIIは,Form IとForm IIの中間に出る).
これまでのStubbeらのデータ5, 6),およびDNAとしてsupercoiled DNAの代わりにオリゴマー(12-mer)を用いた実験では多量の塩基プロペナールの生成が認められるので,スキームVIIに示した過酸化反応は4′位で行われていると推定している.さらに,二核鉄(III)錯体,Fe2(HPTP)錯体30)(HPTP:N,N,N′,N′-テトラ(2-ピリジルメチル)-2-ヒドロキシ-1,3-ジアミノプロパン)も,空気中でDNAを切断できる事実30)もこの機構の正当性を支持している.このスキームVIIの反応は,置換不活性錯体であるコバルト(III)錯体では起きない(高スピン型鉄(III)化合物は置換活性錯体である).よって,鉄(III)-BLMで観測されたDNAのds切断は,コバルト(III)-BLM錯体では起きない6).このことは,コバルト(II)イオンの(HPTP)錯体は,酸素下でss切断は行うが,それ以上(ds切断)を行わない31)ことからも,強く支持されている.
5. おわりに——DNA損傷反応に対する新しい視点——
これまでの結果をまとめてみると,
1)活性BLMとは,Fe(III)-BLM-OOHであるが,これ自身は不安定で短時間で分解する.これは,ペルオキシドイオンが鉄イオンに結合しているBLMを攻撃するためで,スキームIIの反応に相当する.この反応では鉄(III)イオンと,BLMの炭素原子とからのペルオキシドイオンのσ*軌道への電子の流れ込みによってペルオキシドイオンのheterolytic cleavageが誘導される.DNAが近傍に存在すれば,DNAとの相互作用を介してペルオキシドイオンのheterolytic cleavageが誘導され,DNAの水酸化反応・損傷が進行する.
2)コバルト(III)誘導体,Co(III)-BLM-OOHは安定で,DNAが存在しても反応しない.これはコバルトイオンからのペルオキシドイオンのσ*軌道への電子の流れ込みがないからである.DNAの存在下,紫外線照射で初めてCo(III)-BLM-OOHのペルオキシドイオンのheterolytic cleavageが誘導され,4′-OH誘導体が生成する.
3)鉄(III)-BLMそれ自身が酸素分子の存在下でDNAと反応し,4′-OOH誘導体形成を経てDNA損傷反応を引き起こすことがds切断と密接に関連していると推定された.
これらの事実から,鉄(III)-BLM-ペルオキシド付加体の高いDNA切断能は,鉄イオンとDNA分子からペルオキシドイオンのσ*軌道への電子の流れ込みで誘導されるペルオキシドイオンのheterolytic cleavageに起因することが明らかであり,Stubbeらが主張するような水素原子引き抜きによる4′位炭素ラジカル生成がDNA損傷反応の主たる因子ではないと考えられる.
現状では,BLMは抗腫瘍剤としての活用が期待されているが,最大の難点はかなり毒性が高い点である.その毒性発現は主としてDNAのds切断作用に由来すると指摘されている6).このds切断は,厳密に酸素存在下でのみ起きるので6),スキームVIIで示した中間体形成を行わない新しいBLM誘導体の合成が待たれる.
ごく最近,西田は「鉄イオン制御を母体とする医療(Labile Iron Controlling Therapy:LICT)4, 32)」の実現を目指して,生体毒性を示さない新規鉄キレート剤を合成した33).これらの鉄キレート剤が高い抗腫瘍性・抗菌作用・抗ウイルス作用を示すこと34)と,BLM類は有力な鉄キレート剤であることを考慮すると,BLMによる抗腫瘍性は,鉄イオンを制御してがん細胞増殖を抑えている35)ことも一因と考えられ,この視点からの新しいBLM誘導体の開発が期待される.
引用文献References
1) Perez, V.I., Buffenstein, R., Masamsetti, V., Leonard, S., Salmon, A.B., Mele, J., Andziak, B., Edrey, Y., Friguet, B., Ward, W., et al. (2009) Protein stability and resistance to oxidative stress are determinants of longevity in the ingest-living rodent, the naked mole-rat. Proc. Natl. Acad. Sci. USA, 106, 3059–3064.
2) 岡香織,三浦恭子(2016)老化・がん化耐性研究の新たなモデル:ハダカデバネズミト長寿動物を用いた老化学.生化学,88, 71.
3) Halliwell, B. & Gutteridge, J.M. (2007) Free Radicals in Biology and Medicine, Oxford University Press, New York.
4) 阿部啓太,西田雄三(2018)神経疾患と金属イオン,一粒書房.
5) Stubbe, J. & Kozarich, J.W. (1987) Mechanism of bleomycin-induced DNA degradation. Chem. Rev., 87, 1107–1136.
6) Murray, V., Chen, J.K., & Chung, L.H. (2018) The interaction of the metallo-glycopeptide anti-tumor drug bleomycin with DNA. Int. J. Mol. Sci., 19, 1372.
7) Mizuno, R., Kawabata, T., Sutoh, Y., Nishida, Y., & Okada, S. (2006) Oxidative renal tubular injuries induced by aminocarboxylate-type iron(III) coordination compounds as candidate renal carcinogenesis. Biometals, 19, 675–683.
8) Kasai, H. & Nishimura, S. (1984) Hydroxylation of deoxyguanosine at the C-8 position by ascorbic acid and other reducing agents. Nucleic Acids Res., 12, 2137–2145.
9) Nishimura, S. (2011) 8-hydroxyguanine:a base for discovery. DNA Repair (Amst.), 10, 1078–1083.
10) Chernikov, A.V., Gudkov, S.V., Usacheva, A.M., & Bruskov, V.I. (2017) Exogenous 8-oxo-7,8-dihydro-2′-deoxyguanosine: Biochemical properties, mechanism of action, and therapeutic potential. Biochemistry (Mosc.), 82, 1686–1701.
11) Harrison, P.M. & Arosio, P. (1996) The ferritins: Molecular properties, iron storage function and cellular regulation. Biochim. Biophys. Acta, 1275, 161–203.
12) Nishida, Y., Goto, A., Akamatsu, T., Ohba, S., Fujita, T., Tokii, T., & Okada, S. (1994) Iron chelates in biological system: Its relevance to induction of pathogenesis of tissue damage and carcinogenesis. Chem. Lett., 1994, 641–644.
13) Nishida, Y. & Ito, S. (1995) Structures and reactivity of several iron(III) complexes in the presence of hydrogen peroxide: Relevance to induction of tissue damage caused by iron(III) chelates. Polyhedron, 14, 2301–2308.
14) Ito, S., Sasaki, Y., Takahashi, Y., Ohba, S., & Nishida, Y. (1999) Oxygenation of nucleosides by peroxide adducts of binuclear iron(III) complex with a μ–oxo bridge. Z. Naturforsch, 54c, 554–561.
15) Nishida, Y. & Ito, S. (1995) High activity of an Fe-tfda complex for hydroxylation at the aromatic ring of 2-deoxyguanosine in the presence of hydrogen peroxide. Chem. Soc. Chem. Commun., 1995, 1211.
16) Ito, S., Okuno, T., Itoh, H., Ohba, S., Matsushima, H., Tokii, T., & Nishida, Y. (1997) Z. Naturforsch., chemical basis for high activity in oxygenation of cyclohexane catalyzed by binuclear iron(III) complexes with ethereal-oxygen containing ligand and hydrogen peroxide. Z. Naturforsch, 52b, 719.
17) Sugiyama, H. & Saito, I. (1996) Theoretical studies of GC-specific photocleavage of DNA via electron transfer:significant lowering of ionization potential and 5′-localozation of HOMO of stacked GC bases in B-form DNA. Amer. Chem. Soc, 118, 7063–7068.
18) Umezawa, H., Maeda, K., Takeuchi, T., & Okami, Y. (1966) New anitibiotics bleomycin A and B. J. Antibiot, 19, 200–209.
19) Goodwin, K.D., Lewis, M.A., Long, E.C., & Georlads, M.M. (2008) Crystal structure of DNA-bound Co(III)-bleomycin B2: Insights on intercalation and minor groove binding. Proc. Natl. Acad. Sci. USA, 105, 5052–5056.
20) Nishida, Y., Kunita, M., & Nishino, S. (1999) Mechanism of DNA cleavage due to green cobalt(III)-bleomycin hydroperoxide intermediate irradiated by visible light. Inorg. Chem. Commun., 2, 156–157.
21) Nishida, Y., Ito, S., & Nishino, S. (2003) The important role of an unpaired d-electron for terminal oxygen atom transfer reaction of the (hydroperoxo)iron(III) compound. Polyhedron, 22, 293–297.
22) Nishida, Y. (1998) Important role of substrate in activation for dioxygen in biological oxygenases. Trends Inorg. Chem., 5, 89.
23) 西田雄三(1998)酸素添加酵素における酸素分子の活性化に及ぼす基質の役割.日本化学会誌,1998, 794.
24) Nishida, Y. & Nishino, S. (2001) Electronic property and reactivity of (hydroperoxo)metal compounds. Z. Naturforsch, 56c, 144–153.
25) Nishida, Y. (2012) Oxygen Activation, Oxidative Stress, and Human Health, LAP Lambert Academic Publishing, Saarbrucken, Germany.
26) Decker, A., Chow, M.S., Kemsley, J.N., Lehnert, N., & Solomon, E.I. (2008) Direct hydrogen atom abstraction by activated bleomycin: An experimental and computational study. J. Am. Chem. Soc., 128, 4719–4733.
27) Nishida, Y. & Tanaka, N. (1994) Chemical mechanism of dioxygen activation by trans-[FeCl2(cyclam)]in the presence of reducing agents such aliphatic aldehyde or linolenic acid. J. Chem. Soc., Dalton Trans., 1994, 2805.
28) Nishida, Y. & Yamada, K. (1990) Lipoxygenase-like function of some binuclear iron(III) compounds. J. Chem. Soc., Dalton Trans., 1990, 3639.
29) Kobayashi, T., Guo, L.L., & Nishida, Y. (1998) Mechanism of double-strand DNA cleavage effected by iron-bleomycin. Z. Naturforsch, 53c, 867–870.
30) Nishino, S., Kobayashi, T., Kunita, M., Matsushima, H., & Tokii, T. (1999) Interaction between the peroxide adduct of binuclear iron(III) complex with H(HPTP) and the sugar moiety of nucleosides. Z. Naturforsch, 54b, 1272–1276.
31) Nishida, Y., Nishino, S., Guo, L., Kunita, M., Matsushima, H., & Tokii, T. (1999) DNA promotes the activation of oxygen molecule by binuclear cobalt(II) compounds. Inorg. Chem. Commun., 2, 609–611.
32) Nishida, Y. (2015) Iron chelators for labile iron removal therapy and enhancement of longevity. Eur. J. Biol. Med. Sci. Res, 3, 42.
33) Nishida, Y. WO/2016/052488.
34) Ohara, T., Tomono, Y., Boyi, X., Yingfu, S., Omori, K., & Matsukawa, A. (2018) A novel, non-toxic iron chelator, super-polyphenol, effectively induces apoptosis in human cancer cell lines. Oncotarget, 9, 32751–32760.
35) Ohara, T., Noma, K., Watanabe, S., Nishitani, S., Tomono, Y., Kimura, F., Kagawa, S., Shirakawa, Y., & Fujiwara, T. (2013) A novel synergistic effect of iron depletion on antiangiogenic cancer therapy. Int. J. Cancer, 132, 2705–2713.