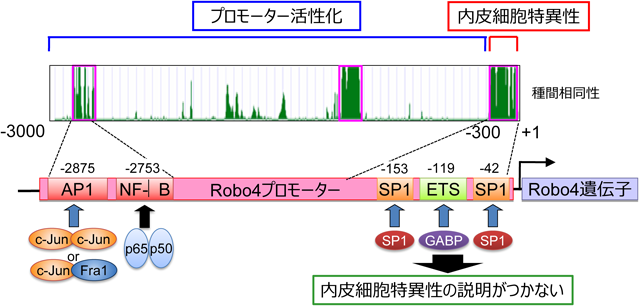
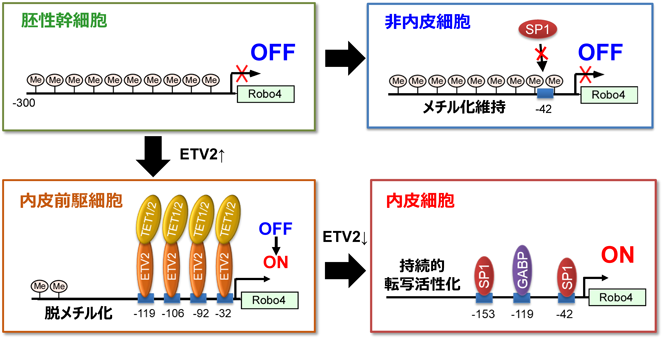
血管内皮細胞特異的に遺伝子が発現するメカニズムEndothelial cell-specific gene expression induced by transcription factors and epigenetics
大阪大学大学院薬学研究科生命情報解析学分野Graduate School of Pharmaceutical Sciences, Osaka University ◇ 〒565–0871 大阪府吹田市山田丘1–6 ◇ 1–6 Yamadaoka, Suita, Osaka 565–0871, Japan