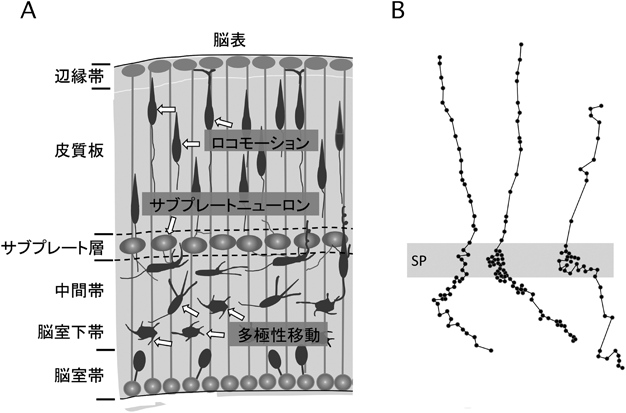
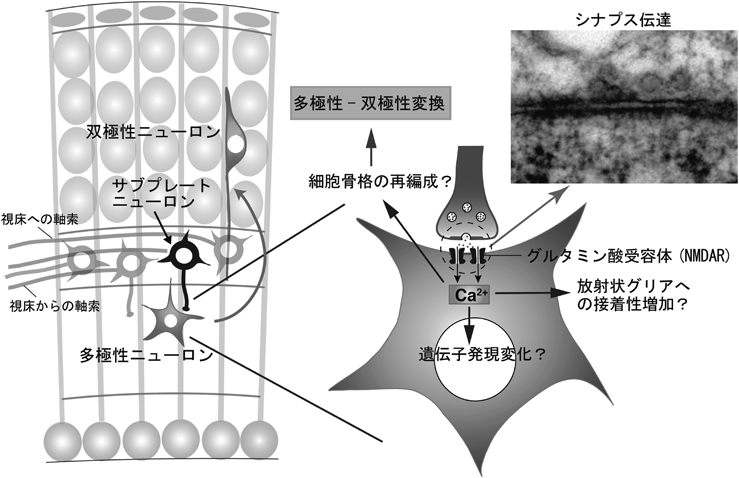
サブプレートニューロンからのシナプス伝達が大脳新皮質における神経細胞移動を制御するSynaptic transmission from subplate neurons controls radial migration of neocortical neurons
公益財団法人東京都医学総合研究所・神経回路形成プロジェクトNeural Network Project, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–8506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo 156–8506, Japan