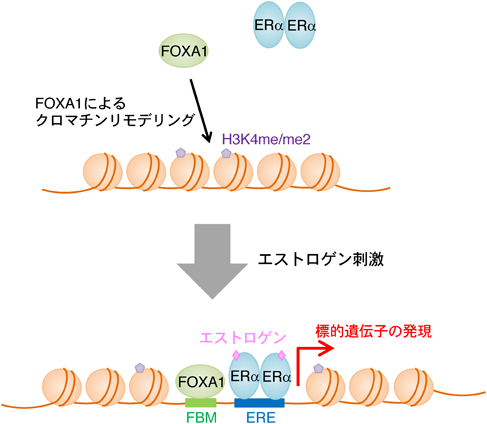
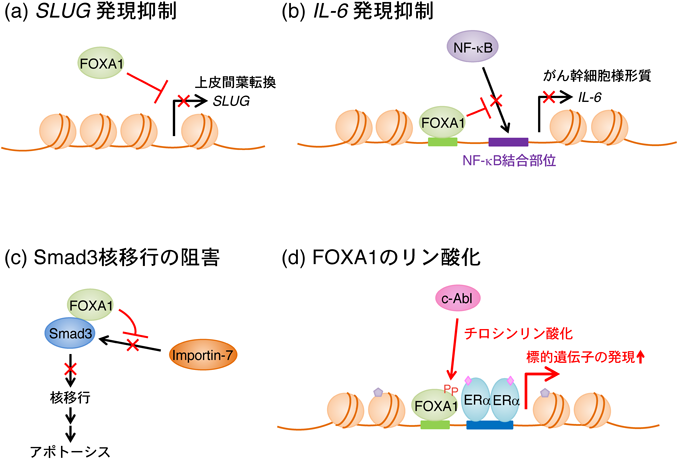
乳がん細胞におけるクロマチン制御因子FOXA1の多面的機能FOXA1 as a double-edged sword in breast cancer development
1 千葉大学大学院薬学研究院・分子心血管薬理学Department of Molecular Cardiovascular Pharmacology ◇ 〒260–8675千葉県千葉市中央区亥鼻1–8–1 ◇ Inohana 1–8–1, Chuo-ku, Chiba 260–8675, Japan
2 千葉大学大学院薬学研究院・分子細胞生物学Laboratory of Molecular Cell Biology Graduate School of Pharmaceutical Sciences, Chiba University ◇ 〒260–8675千葉県千葉市中央区亥鼻1–8–1 ◇ Inohana 1–8–1, Chuo-ku, Chiba 260–8675, Japan