脳内における神経回路網の形成過程は,神経細胞の増殖,移動,極性形成,軸索ガイダンス,シナプスの形成といった複数のステップにより構成される.神経回路形成の研究は歴史が古く,一例として,1890年にラモニ・カハールにより軸索の先端にある構造体として神経成長円錐が発見され,彼は,成長円錐が細胞外の化学シグナルを検知して推進力を生み出し,軸索の伸長やガイダンスを引き起こすと予想した1, 2).その後,数多くの神経科学者が軸索伸長やガイダンスに魅了されて研究を続け,軸索ガイダンス分子やその受容体,さらに受容体活性化により引き起こされる細胞内シグナル伝達経路が明らかとなってきた3, 4).しかし,細胞外の化学シグナルによって活性化されるシグナル伝達が,最終的にいかにして軸索伸長ガイダンスのための推進力に変換されるのかその分子メカニクスは長らく未解明だった.
Shootin1は,13年前に著者らのグループにより神経細胞の極性形成を担う新規タンパク質として同定された5, 6).その後,Shootin1を介した自発的な神経極性形成の数理モデルが提出され,さらに最近,Shootin1が,軸索ガイダンスや細胞移動,細胞内分子輸送にも関わることが報告された.特に,Shootin1が重合・脱重合を繰り返すアクチン線維や細胞接着分子とともに細胞移動や細胞形態形成のための細胞-基質間の力の発生を担う分子マシーナリーを構成することが明らかとなり,Shootin1の解析を通じて軸索ガイダンスや新しい細胞内分子輸送の分子メカニクスがわかってきた.さらに,Shootin1が関与する軸索ガイダンスのメカニズムの破綻が小児の神経難病の原因となることを示唆する解析データも得られてきている.本稿では,Shootin1を介した細胞-基質間の力の発生機構を踏まえて,これまでに明らかとなってきたShootin1とその関連分子の持つ分子機能を解説する.
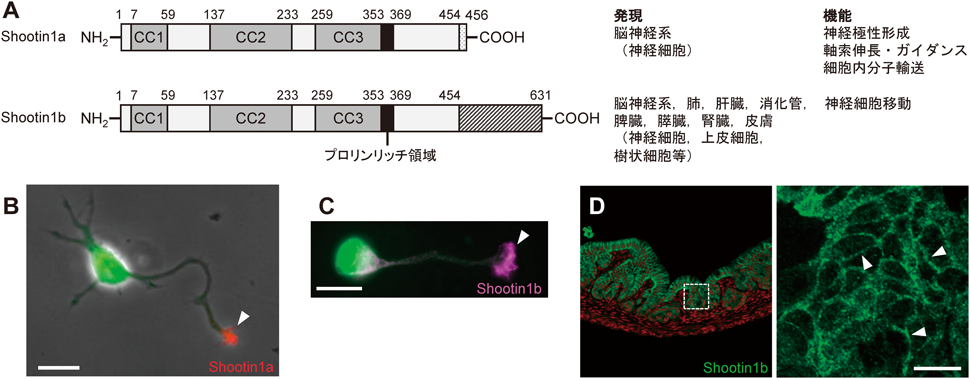
著者らは,93 cm×103 cmのラージゲルを用いた高感度二次元電気泳動システム7–9)を利用して,ラット培養海馬神経細胞の軸索に濃縮するタンパク質と神経極性形成前後で発現量が上昇するタンパク質をダブルスクリーニングし,新規の脳特異タンパク質を同定した5).このタンパク質は,後述のように,アクチン波10)とともに神経細胞の細胞体から突起先端に向かってまるでサッカーボールがシュートされるように塊となって移動するので(図6A参照),Shootin1と名づけられた.Shootin1は3個のコイルドコイル(CC)領域と1個のプロリンリッチ領域を有しているが(図1A),その立体構造は不明である.また,著者らは最近,ヒト,マウス,ラットにおいて,脳に加えて肺や肝臓,消化管,脾臓,膵臓,腎臓,皮膚等の末梢組織にも発現するShootin1のスプライシングバリアントを同定し,前者の脳特異的Shootin1をShootin1a,脳と末梢組織の両方に発現するShootin1をShootin1bと呼んでいる(図1A)11).Shootin1の細胞内局在の一例として,Shootin1aは培養海馬神経細胞の軸索先端の成長円錐に濃縮する(図1B)5).一方,Shootin1bは移動する嗅球抑制性神経細胞では先導突起の成長円錐に濃縮し(図1C)12),また,上皮細胞では細胞接着部位に局在する(図1D)11).
3. 軸索形成・神経極性形成分子としてのShootin1a
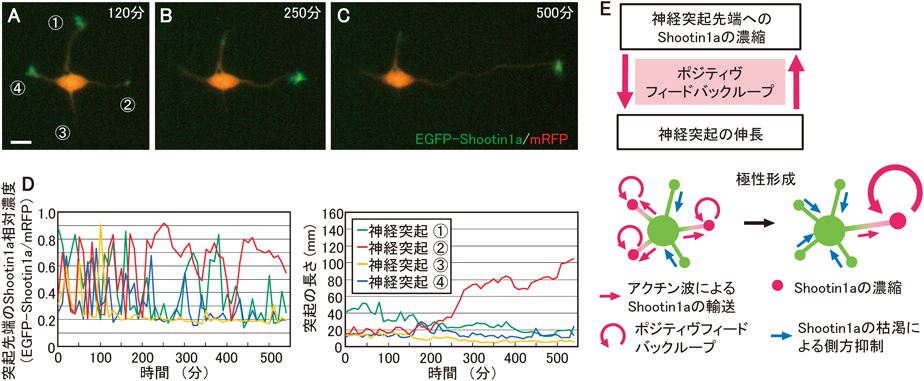
Shootin1aの機能として,最初に,ラット培養海馬神経細胞の極性形成への関与が報告された5, 6).培養海馬神経細胞は,極性形成の過程で,まず細胞体から軸索にも樹状突起にもなりうる複数の未成熟な突起を伸ばす13, 14)(ステージ2).この時点では,各突起の長さはほぼ同じで,神経細胞は対称にみえる(図2A).その後,これらの突起のうち1本が急激に伸長し,対称性が破れる.そして,この突起は急激な伸長を続けて軸索へ分化し(ステージ3)(図2C),残りの突起が樹状突起へと分化して神経細胞は極性を獲得する13, 14).極性形成過程のステージ2では,Shootin1aは細胞体から複数の未成熟な突起の先端に向かってアクチン波(後述)10)により塊となって運ばれる5, 15).それに伴い,Shootin1aは未成熟な突起の先端でゆらぐように濃縮と消失を繰り返す(図2A, D).また,神経突起先端におけるShootin1aの濃縮は突起伸長を引き起こし,Shootin1aの神経突起先端における濃度のゆらぎに伴って神経突起もダイナミックに伸長と退縮を繰り返す(図2D).やがてShootin1aは1本の突起に持続的に集積して,他の突起からほぼ消失する(図2B, D).その結果,1本の突起が急激に伸びて対称性を破って軸索となり,神経極性が形成される(図2C, D).Shootin1aを過剰発現させた場合,Shootin1aが複数の突起に濃縮して軸索が複数形成される.一方,RNAiによりShootin1aの発現を抑制すると神経極性形成に遅れが生じる5).この結果から,Shootin1aは,神経細胞から1本の軸索を形成する極性形成分子として機能すると考えられる5).
さらに,神経極性形成の鍵となるShootin1aの以下の挙動が観察された.
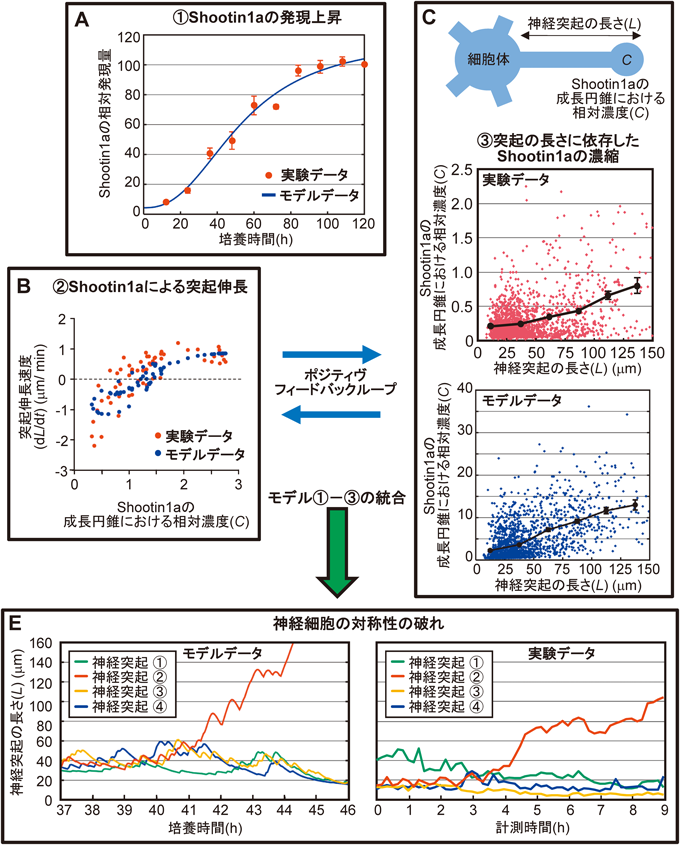
- ①Shootin1aは,神経極性形成過程で発現量が急激に増加する(赤データ,図3A)5).
- ②Shootin1aが神経突起先端に濃縮すると突起を伸長させる(赤データ,図3B)5).
- ③突起先端で濃縮したShootin1aは逆行性に細胞体に向かって拡散するため,長い突起ほど突起先端と細胞体との間のShootin1aの濃度勾配が小さくなり,逆行性の拡散速度が遅くなる.これによって長い突起ほどShootin1aが濃縮しやすくなる(赤データ,図3C)16).
そこで,定量実験データから①~③のShootin1aの挙動を定量的に記述する数理モデルを作成し(青データ,図3B~C),これらを統合してモデル神経細胞を構築したところ(緑矢印,図3),モデル神経細胞は培養神経細胞と同様に自発的な対称性の破れを引き起こした(図3E)16).さらに,この数理モデルは軸索切断後の再生やShootin1aの過剰発現による過剰軸索形成を含む15のさまざまな実験データを記述することができ16),現時点ではモデルから得られるデータと実験データの間に矛盾はみられていない.したがって,Shootin1aの①~③の挙動が,神経極性形成を引き起こすと考えられる.
このモデルから結論できる神経細胞が対称性を破る仕組みは以下のとおりである.まず,極性形成前の未成熟な神経突起に,Shootin1aの発現量の上昇(①)とともにShootin1aを突起先端に輸送するアクチン波がランダムに出現し,アクチン波によるShootin1aの輸送が偶然多く発生した突起は他の突起よりも長くなる(②).すると,さらにその突起にシューティンが濃縮しやすくなり(③),突起伸長が加速する(②).すなわち,突起の伸長(②)とShootin1aの濃縮(③)との間にポジティヴフィードバックが生じる(図2E).さらに,細胞内のShootin1aの量は限られているので,1本の突起にShootin1aが集まると他の突起に輸送されるShootin1aが枯渇し,結果として他の突起の伸長が抑制され(側方抑制),神経細胞の対称性が破れて極性が形成される(図2E).このモデルは,側方抑制のための他の分子を必要としない“One-takes-all”モデルであり,Shootin1aの挙動(①~③)だけで極性形成を説明することが可能である17).しかし,神経細胞には,Shootin1aによる極性形成の安定化に関与するSingar118)も含めてさまざまな極性関連分子が報告されており14, 19–21),Shootin1aが神経細胞内でこれらの分子と協働することにより,安定した極性形成が引き起こされると考えられる.
4. 重合・脱重合を繰り返すアクチン線維と細胞接着を連結するクラッチ分子Shootin1a
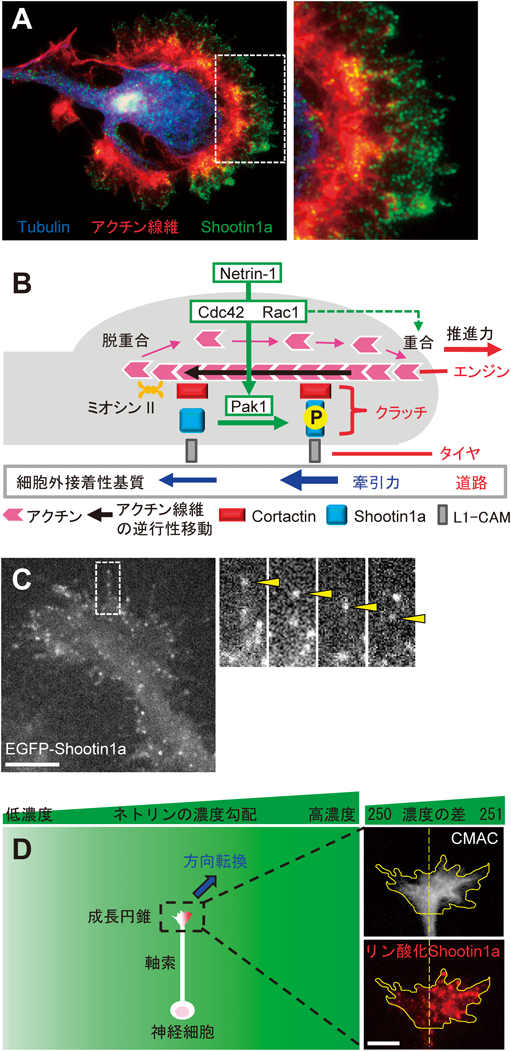
Shootin1aがいかにして未成熟な神経突起や軸索の伸長を引き起こすのか,その分子メカニクスも明らかとなってきた22–24).Shootin1aによる軸索伸長機構を説明するには,関与する分子を車の部品にたとえると理解しやすい.軸索の伸長やガイダンスには,軸索先端に存在する成長円錐が重要な役割を果たすが3),Shootin1aは成長円錐の糸状仮足や葉状仮足でアクチン線維と共局在する(図4A)22).成長円錐の糸状仮足や葉状仮足では,アクチン線維が軸索の伸長方向に向かって重合し反対側で脱重合をするため,アクチン線維は軸索の伸長方向とは逆方向に移動する(黒矢印,図4B)25, 26).アクチン線維の逆行性移動にはミオシンIIも関与することが報告されており27),逆行性移動にはアクチン分子とミオシンIIによるATP加水分解エネルギーが必要とされる.このATPの加水分解エネルギーを使って逆行性移動するアクチン線維は,車のエンジンの役割を果たす(図4B).
一方,軸索成長円錐の細胞膜上に存在する細胞接着分子L1-CAM28)は,隣接細胞の細胞膜上のL1-CAMや細胞外基質上のラミニン等と結合することにより29–31),道路の役割を果たす接着性基質をとらえるタイヤとして機能する(図4B).Shootin1aは,アクチン結合分子Cortactin32)との直接結合を介して成長円錐で逆行性移動をするアクチン線維と相互作用する23)ため,アクチン線維とともに逆行性移動する22)(図4C).また,Shootin1aは細胞接着分子L1-CAMとも直接結合する24).このようにして,Shootin1aとCortactinはアクチン線維(エンジン)の動き(黒矢印,図4B)をL1-CAM(タイヤ)に伝えて路面に牽引力(青矢印,図4B)を生み出すクラッチの役割を果たす(図4B).このような,重合・脱重合を繰り返すアクチン線維と細胞接着を連結するリンカー分子は,MitchisonとKirschnerにより提唱され,クラッチ分子と呼ばれている3, 33, 34).軸索伸長のための推進力(赤矢印,図4B)は,タイヤが路面に及ぼす牽引力(青矢印,図4B)の反作用として生じる23, 24).
5. Shootin1aのリン酸化によるシグナル伝達の力への変換と軸索ガイダンス(走化性)
軸索伸長や細胞移動の方向は,細胞外環境の化学物質によって調節を受けることが知られており,軸索ガイダンスや細胞移動の様式は,運動方向を決定する細胞外化学分子の種類によって,拡散性化学物質に誘引される走化性(chemotaxis)と細胞外接着性基質上の化学物質に調節を受ける走触性(haptotaxis)が知られている.最近,Shootin1aが,誘引性軸索ガイダンス分子Netrin-135, 36)によって引き起こされる軸索の走化性に重要な役割を果たすことがわかってきた24).Netrin-1により成長円錐上の受容体deleted in colorectal cancer(DCC)が活性化されると,Rac1とCdc42の活性化を介してリン酸化酵素Pak1によりShootin1aのSer101とSer249がリン酸化される(緑矢印,図4B)37).その結果,Shootin1aとCortactinの結合23)およびShootin1aとL1-CAMの結合24)の双方が強まることでクラッチ連結が増強し,逆行性移動するアクチン線維からL1-CAMを介して細胞外基質に伝わる牽引力が強まり,軸索の伸長が促進される23, 24).すなわち,Netrin-1によって引き起こされる細胞内シグナル伝達は,Shootin1aのリン酸化をreadoutとして軸索伸長のための力に変換される(図4B).
一方,Rac1とCdc42の活性化はアクチン線維の重合も促進することが知られており38, 39),車のたとえでは,アクチン線維の重合促進はエンジンの回転数の上昇にあたると考えられる(緑破線矢印,図4B).そこで,アクチン線維の重合促進のみでシグナル伝達の力への変換が可能かを調べるために,Shootin1aのクラッチ機能を阻害した条件下で成長円錐にNetrin-1刺激を加えたところ,アクチン線維の逆行性移動の速度は早まるものの牽引力の高まりや軸索伸長の促進はみられなかった23, 24, 37).これは,エンジンの空回りに相当し,この結果からShootin1aよるクラッチ連結の増強が軸索伸長促進の力の発生のために必須であると結論できる.すなわち,Shootin1aのリン酸化によるクラッチ連結の促進とアクチン線維の重合促進の相補的な働きによって,Netrin-1によるシグナル伝達が効率よく軸索伸長の力に変換されると考えられる(図4B).
Shootin1のノックアウトマウスは,Netrin-1やその受容体DCCのノックアウトマウス40, 41)同様,前脳交連線維の形成とガイダンスに異常が生じる24).また,Rac1やL1-CAMのノックアウトマウスでも同様の前脳交連線維の異常が報告されている42–44).そこで,マイクロ流路を用いてNetrin-1の濃度勾配を作製し,培養海馬神経細胞の軸索成長円錐の挙動を解析した.その結果,わずか250分子:251分子の違いに相当する0.4%のNetrin-1濃度勾配に反応して,成長円錐内においてNetrin-1の多い側にShootin1aの強いリン酸化が観察され,軸索伸長がNetrin-1の多い側に向かって方向転換することがわかった(図4D)24).また,シグナル伝達によって調節を受けることができない恒常活性型のShootin1aを発現する神経細胞では,軸索は伸びることができるもののNetrin-1に向かった走化性は起こらなかった.これらの結果から,Shootin1aがわずかなNetrin-1の濃度差に高感度に反応して成長円錐内で非対称な活性化を起こし,軸索の伸長方向を決定すると考えられる24).
6. L1-CAMのGrip & Slipによる軸索ガイダンス(走触性)の新たな仕組み
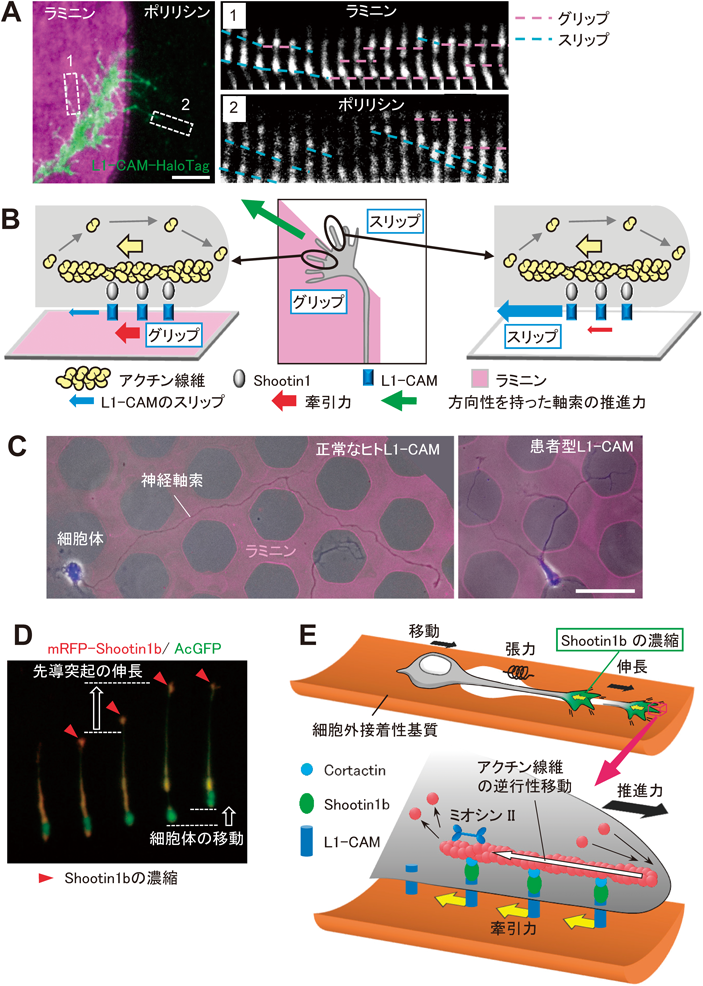
ラミニンは,細胞外基質を構成する主要なタンパク質であり,誘因性の軸索の走触性を引き起こすことが知られている45–47).神経細胞をラミニンとポリリシンのマイクロパターン上に培養すると,神経細胞はラミニンに沿って軸索を伸ばしたが,Shootin1a, L1-CAM,アクチン線維,Cortactinをノックダウンする,あるいはアクチン線維の重合やミオシンIIを阻害すると,軸索はラミニンに沿って伸びることができなくなった31).この結果から,図4Bに示すShootin1a, Cortactin, L1-CAM,アクチン線維,ミオシンIIからなる分子マシーナリーがラミニンによる軸索の走触性においても必要であると考えられる.
また,成長円錐では,ラミニン上ではタイヤにあたるL1-CAMが路面にあたる細胞外基質をとらえて(グリップして)牽引力を効率的に生み出し,一方,ポリリジシ上ではL1-CAMが後ろ向きにスリップして牽引力が基質にうまく伝わらないことがわかった(図5A)31).以上の結果から,軸索先端がL1-CAMと細胞外基質との摩擦力の差によるグリップとスリップを巧妙に利用して正しい方向に進んでゆくことが明らかとなった(図5B).これまでにラミニンによる走触性のモデルとして,軸索先端の細胞内シグナル伝達が重要な役割を果たすことが提唱されていたが46, 48),シグナル伝達に依存せず,細胞と細胞外環境の間に生じる分子の滑りと力を利用した新たな走触性の仕組み(Grip & Slip機構)が明らかとなった(図5B)31).
ヒトのL1-CAM遺伝子に変異が起こると,軸索ガイダンスの障害や精神発達遅滞,失語症,歩行障害等の症状を伴う小児の神経難病であるL1症候群を引き起こすことが知られている49, 50).そこでL1症候群の患者に由来するThr273を欠失したL1-CAM変異体50, 51)を解析したところ,この変異体では,上述のGrip & Slip機構に障害が生じて,軸索のラミニンに沿った走触性が起こらなくなることが明らかとなった(図5C)31).このことから,L1症候群に伴う軸索ガイダンス障害の一因として,L1-CAMによるGrip & Slip機構の破綻が考えられる31).
7. Shootin1bを介した神経細胞の細胞移動
神経細胞は,発生時期の脳内で大規模な移動を行い脳を構築する.神経細胞の細胞移動の特徴として,先導突起の伸長と細胞体の移動を交互に繰り返すことで,目的地に向かって移動することが知られている(図5D)52–54).また,成体においても,脳室下帯で産生された抑制性の神経細胞(neuroblast)が嗅球に向かって吻側移動経路(rostral migratory stream)に沿って移動し,嗅球に新しい神経細胞が供給される54).神経細胞の細胞移動を担うクラッチ分子は不明だったが,最近,図4Bと同様の分子機構が,神経細胞の細胞移動にも関与することがわかってきた.Shootin1のノックアウトマウスでは,吻側移動経路を移動する神経細胞の移動速度の低下と嗅球の形成不全がみられる12).移動する神経細胞の先導突起の成長円錐ではShootin1bが濃縮し(図1C),軸索成長円錐におけるShootin1aと同様に,Shootin1bがCortactinとL1-CAMとの直接結合を介して重合・脱重合を繰り返すアクチン線維と細胞接着を連結するクラッチ分子として機能する(図5E)12).その結果,Shootin1bの濃縮により牽引力が発生して(図5E)先導突起が伸長する(図5D).さらに,先導突起の伸長により先導突起にかかる張力が高まることで,結果的に細胞体の移動が起こると考えられる(図5E)12).
8. Shootin1を介した新しい細胞内分子輸送機構アクチン波
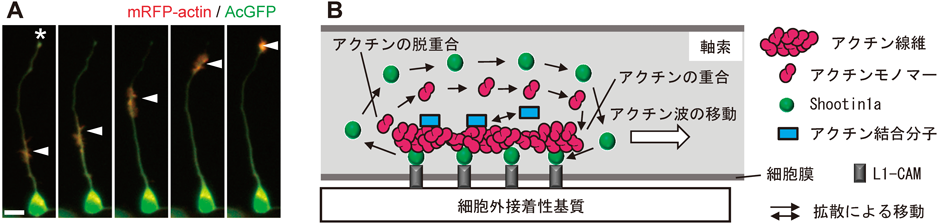
「アクチン波」は,アクチン線維がアクチン関連分子とともに細胞内を移動する現象であり,約20年前にRuthelとBankerによってその存在が初めて報告されて以来55),軸索形成時の神経細胞や好中球,粘菌,線維芽細胞を含むさまざまな細胞で観測されている10).RuthelとBankerは,アクチン波を細胞内分子輸送の新しい機構として捉え55),これまでに数理科学者を含む数多くの研究者によりアクチン波の解析がなされてきた10, 56).特に,理論系の研究者の多くは,アクチン波の移動メカニズムについて化学的な反応拡散方程式を用いた説明を試みてきたが,分子レベルの理解には至っていなかった10, 56).また,さまざまな細胞で観測されているアクチン波がすべて同じメカニズムで移動するのかも不明である56).前述のように,Shootin1aはアクチン波とともに神経細胞の細胞体から突起の先端に移動して(図6A),軸索形成や神経極性形成に重要な役割を果たす5, 16).最近,神経軸索内で移動するアクチン波のShootin1aを介した移動メカニズムが報告された15).
すなわち,高解像度ライブイメージングを行ったところ,アクチン波に存在するアクチン線維の重合端がアクチン波の進行方向に向いていることがわかった(図6B)15).アクチン波内のアクチン線維は,軸索や先導突起の成長円錐(図4B, 5E)と同様にShootin1aとCortactin, L1-CAMを介して細胞膜にアンカリングされており,アクチン線維の膜への連結を弱めるとアクチン波の移動速度は遅くなり,逆にアクチン線維の膜への連結を強めるとアクチン波の移動速度は速くなった15).また,アクチン波の移動がアクチン線維の重合・脱重合に依存することもわかり,アクチン波の移動に伴って細胞外接着性基質上に伝わる力も検出された.さらに,
- ①アクチン波内のアクチン線維の方向性を持った重合・脱重合
- ②アクチン線維の細胞膜へのアンカリング
- ③Shootin1aとアクチン線維結合タンパク質のアクチン線維への結合・解離
- ④アクチンモノマーやShootin1a,アクチン結合タンパク質の拡散
からなる定量的な数理モデルを構築したところ,軸索に沿ったアクチン波によるアクチンとアクチン結合タンパク質の細胞内移動を再現することができた15).以上の結果から結論できるアクチン波の移動の仕組みとして,以下が考えられる.アクチン線維は,細胞膜にアンカリングされているので,重合するアクチン分子の大きさの分だけ重合端に向かって細胞膜上を移動する(白矢印,図6B).アクチン波の進行速度は十分に遅く(0.02~0.09 µm/s),脱重合端から放出されたアクチンモノマーとShootin1a分子は,拡散によって前方に移動してプラス端で再利用される(黒矢印,図6B).また,このようにして細胞内を移動するアクチン線維は,アクチン結合分子質群を輸送するための足場としても機能する15).
このメカニズムでは,アクチン波内のアクチン分子やアクチン結合分子が安定した複合体を形成して複合体として軸索内を移動するわけではない点が特徴的である.すなわち,個々のアクチン分子やアクチン結合分子はアクチン波と細胞質の拡散性プールとの間をシャトルする(図6B).また,アクチン線維の脱重合端では,アクチン分子やアクチン結合分子がアクチン波から放出されるので,これらの分子の局所的な濃度が高まる.一方,アクチン線維の重合端では,アクチン分子やアクチン結合分子がアクチン波に取り込まれるので,これらの分子の局所的な濃度が低下する.これにより,アクチン波の前後でアクチン分子とアクチン結合分子の局所的な濃度勾配が形成され,アクチン分子とアクチン結合分子が自由拡散によって前方に移動する(黒矢印,図6B).このように,神経軸索を移動するアクチン波は,従来知られているキネシン,ダイニン,ミオシン等のモータータンパク質による細胞内輸送とはまったく異なるメカニズムで細胞内を移動する新しいタイプの細胞内分子輸送機構であることがわかった10, 15).さらに,アクチン波による分子輸送の機能を調べるためにアクチン波の輸送を阻害したところ,軸索の伸長が阻害された.したがって,アクチン波は,軸索伸長に必要なアクチン分子やアクチン関連分子の成長円錐への供給機構としての役割を持つと考えられる15).
最近のShootin1の分子機能の解析を通じて,Shootin1が重合・脱重合を繰り返すアクチン線維と細胞接着分子を連結することで細胞と細胞外基質の間に力を生み出すことが明らかとなってきた.また,神経細胞の極性形成,軸索ガイダンス,細胞移動,細胞内分子輸送の分子メカニクスの一端が,Shootin1による細胞–基質間の力の発生という視点(図4B, 5E, 6B)を導入することで解明されつつある.Shootin1bは,神経細胞以外にも末梢組織の樹状細胞に発現し,さまざまな上皮細胞の接着部位にも局在する11).したがって,今回述べたShootin1を介した細胞–基質間の力の発生が,より幅広い細胞機能を遂行する可能性がある.また,Shootin1は,アクチン線維や細胞接着分子以外にもPI3キナーゼ5),Profilin57),KIF20B58, 59),Rnaset260),CDKL561)といった分子と相互作用をすることが報告されており,最近,Shootin1によるNotchシグナリングの活性化も報告された62).さらに,Shootin1のL1-CAMとの相互作用を介したL1症候群の発症への関与31)に加えて,Shootin1遺伝子の変異による口唇口蓋裂の発症も示唆されている63).今後のShootin1の解析を通じて,力を介した細胞形態形成の分子メカニクスとその破綻による病態がさらに明らかとなることを期待したい.
引用文献References
1) Ramon y Cajal, S.R. (1892) La rétine des vertébrés. Cellule, 9, 121–133.
2) Sotelo, C. (2002) The chemotactic hypothesis of Cajal: a century behind. Prog. Brain Res., 136, 11–20.
3) Lowery, L.A. & Van Vactor, D. (2009) The trip of the tip: understanding the growth cone machinery. Nat. Rev. Mol. Cell Biol., 10, 332–343.
4) Kolodkin, A.L. & Tessier-Lavigne, M. (2011) Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harb. Perspect. Biol., 3, a001727.
5) Toriyama, M., Shimada, T., Kim, K.B., Mitsuba, M., Nomura, E., Katsuta, K., Sakumura, Y., Roepstorff, P., & Inagaki, N. (2006) Shootin1: a protein involved in the organization of an asymmetric signal for neuronal polarization. J. Cell Biol., 175, 147–157.
6) 稲垣直之,鳥山道則,島田忠之(2007)神経極性形成とShootin1のフィードバックループ,生化学,79, 799–802.
7) Inagaki, N. & Katsuta, K. (2004) Large gel two-dimensional electrophoresis: improving recovery of cellular proteome. Curr. Proteomics, 1, 35–39.
8) 馬場健太郎,浦崎明宏,稲垣直之(2014)ラージゲルプロテオミクスを基盤とした神経細胞の軸索形成とガイダンスの解析,電気泳動,58, 49–52.
9) Nomura, E., Katsuta, K., Ueda, T., Toriyama, M., Mori, T., & Inagaki, N. (2004) Acid-labile surfactant improves in-sodium dodecyl sulfate polyacrylamide gel protein digestion for matrix-assisted laser desorption/ionization mass spectrometric peptide mapping. J. Mass Spectrom., 39, 202–207.
10) Inagaki, N. & Katsuno, H. (2017) Actin waves: origin of cell polarization and migration? Trends Cell Biol., 27, 515–526.
11) Higashiguchi, Y., Katsuta, K., Minegishi, T., Yonemura, S., Urasaki, A., & Inagaki, N. (2016) Identification of a shootin1 isoform expressed in peripheral tissues. Cell Tissue Res., 366, 75–87.
12) Minegishi, T., Uesugi, Y., Kaneko, N., Yoshida, W., Sawamoto, K., & Inagaki, N. (2018) Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports, 25, 624–639.
13) Craig, A.M. & Banker, G. (1994) Neuronal polarity. Annu. Rev. Neurosci., 17, 267–310.
14) 勝野弘子,稲垣直之(2016)神経細胞極性,脳科学辞典(林 康紀他編),DOI:10.14931/bsd.17001.
15) Katsuno, H., Toriyama, M., Hosokawa, Y., Mizuno, K., Ikeda, K., Sakumura, Y., & Inagaki, N. (2015) Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports, 12, 648–660.
16) Toriyama, M., Sakumura, Y., Shimada, T., Ishii, S., & Inagaki, N. (2010) A diffusion-based neurite length-sensing mechanism involved in neuronal symmetry breaking. Mol. Syst. Biol., 6, 394.
17) Inagaki, N., Toriyama, M., & Sakumura, Y. (2011) Systems biology of symmetry breaking during neuronal polarity formation. Dev. Neurobiol., 71, 584–593.
18) Mori, T., Wada, T., Suzuki, T., Kubota, Y., & Inagaki, N. (2007) Singar1, a novel RUN domain-containing protein, suppresses formation of surplus axons for neuronal polarity. J. Biol. Chem., 282, 19884–19893.
19) Arimura, N. & Kaibuchi, K. (2007) Neuronal polarity: from extracellular signals to intracellular mechanisms. Nat. Rev. Neurosci., 8, 194–205.
20) Schelski, M. & Bradke, F. (2017) Neuronal polarization:from spatiotemporal signaling to cytoskeletal dynamics. Mol. Cell. Neurosci., 84, 11–28.
21) Hapak, S.M., Ghosh, S., & Rothlin, C.V. (2018) Axon regeneration: antagonistic signaling pairs in neuronal polarization. Trends Mol. Med., 24, 615–629.
22) Shimada, T., Toriyama, M., Uemura, K., Kamiguchi, H., Sugiura, T., Watanabe, N., & Inagaki, N. (2008) Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. J. Cell Biol., 181, 817–829.
23) Kubo, Y., Baba, K., Toriyama, M., Minegishi, T., Sugiura, T., Kozawa, S., Ikeda, K., & Inagaki, N. (2015) Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. J. Cell Biol., 210, 663–676.
24) Baba, K., Yoshida, W., Toriyama, M., Shimada, T., Manning, C.F., Saito, M., Kohno, K., Trimmer, J.S., Watanabe, R., & Inagaki, N. (2018) Gradient-reading and mechano-effector machinery for netrin-1–induced axon guidance. eLife, 7, e34593.
25) Forscher, P. & Smith, S.J. (1988) Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. J. Cell Biol., 107, 1505–1516.
26) Katoh, K., Hammar, K., Smith, P.J., & Oldenbourg, R. (1999) Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Mol. Biol. Cell, 10, 197–210.
27) Medeiros, N.A., Burnette, D.T., & Forscher, P. (2006) Myosin II functions in actin-bundle turnover in neuronal growth cones. Nat. Cell Biol., 8, 215–226.
28) Rathjen, F.G. & Schachner, M. (1984) Immunocytological and biochemical characterization of a new neuronal cell surface component (L1 antigen) which is involved in cell adhesion. EMBO J., 3, 1–10.
29) Grumet, M., Friedlander, D.R., & Edelman, G.M. (1993) Evidence for the binding of Ng-CAM to laminin. Cell Adhes. Commun., 1, 177–190.
30) Hall, H., Carbonetto, S., & Schachner, M. (1997) L1/HNK-1 carbohydrate- and beta 1 integrin-dependent neural cell adhesion to laminin-1. J. Neurochem., 68, 544–553.
31) Abe, K., Katsuno, H., Toriyama, M., Baba, K., Mori, T., Hakoshima, T., Kanemura, Y., Watanabe, R., & Inagaki, N. (2018) Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proc. Natl. Acad. Sci. USA, 115, 2764–2769.
32) Weed, S.A. & Parsons, J.T. (2001) Cortactin: coupling membrane dynamics to cortical actin assembly. Oncogene, 20, 6418–6434.
33) Mitchison, T. & Kirschner, M. (1988) Cytoskeletal dynamics and nerve growth. Neuron, 1, 761–772.
34) Suter, D.M. & Forscher, P. (2000) Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. J. Neurobiol., 44, 97–113.
35) Serafini, T., Kennedy, T.E., Galko, M.J., Mirzayan, C., Jessell, T.M., & Tessier-Lavigne, M. (1994) The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell, 78, 409–424.
36) Lai Wing Sun, K., Correia, J.P., & Kennedy, T.E. (2011) Netrins: versatile extracellular cues with diverse functions. Development, 138, 2153–2169.
37) Toriyama, M., Kozawa, S., Sakumura, Y., & Inagaki, N. (2013) Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Curr. Biol., 23, 529–534.
38) Rohatgi, R., Ma, L., Miki, H., Lopez, M., Kirchhausen, T., Takenawa, T., & Kirschner, M.W. (1999) The interaction between N-WASP and the Arp2/3 complex links Cdc42-dependent signals to actin assembly. Cell, 97, 221–231.
39) Miki, H., Yamaguchi, H., Suetsugu, S., & Takenawa, T. (2000) IRSp53 is an essential intermediate between Rac and WAVE in the regulation of membrane ruffling. Nature, 408, 732–735.
40) Serafini, T., Colamarino, S.A., Leonardo, E.D., Wang, H., Beddington, R., Skarnes, W.C., & Tessier-Lavigne, M. (1996) Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell, 87, 1001–1014.
41) Fazeli, A., Dickinson, S.L., Hermiston, M.L., Tighe, R.V., Steen, R.G., Small, C.G., Stoeckli, E.T., Keino-Masu, K., Masu, M., Rayburn, H., et al. (1997) Phenotype of mice lacking functional Deleted in colorectal cancer (Dcc) gene. Nature, 386, 796–804.
42) Chen, L., Liao, G., Waclaw, R.R., Burns, K.A., Linquist, D., Campbell, K., Zheng, Y., & Kuan, C.Y. (2007) Rac1 controls the formation of midline commissures and the competency of tangential migration in ventral telencephalic neurons. J. Neurosci., 27, 3884–3893.
43) Kassai, H., Terashima, T., Fukaya, M., Nakao, K., Sakahara, M., Watanabe, M., & Aiba, A. (2008) Rac1 in cortical projection neurons is selectively required for midline crossing of commissural axonal formation. Eur. J. Neurosci., 28, 257–267.
44) Demyanenko, G.P., Tsai, A.Y., & Maness, P.F. (1999) Abnormalities in neuronal process extension, hippocampal development, and the ventricular system of L1 knockout mice. J. Neurosci., 19, 4907–4920.
45) Esch, T., Lemmon, V., & Banker, G. (1999) Local presentation of substrate molecules directs axon specification by cultured hippocampal neurons. J. Neurosci., 19, 6417–6426.
46) Turney, S.G. & Bridgman, P.C. (2005) Laminin stimulates and guides axonal outgrowth via growth cone myosin II activity. Nat. Neurosci., 8, 717–719.
47) Randlett, O., Poggi, L., Zolessi, F.R., & Harris, W.A. (2011) The oriented emergence of axons from retinal ganglion cells is directed by laminin contact in vivo. Neuron, 70, 266–280.
48) Nichol, R.H. IV, Hagen, K.M., Lumbard, D.C., Dent, E.W., & Gomez, T.M. (2016) Guidance of axons by local coupling of retrograde flow to point contact adhesions. J. Neurosci., 36, 2267–2282.
49) Kamiguchi, H., Hlavin, M.L., Yamasaki, M., & Lemmon, V. (1998) Adhesion molecules and inherited diseases of the human nervous system. Annu. Rev. Neurosci., 21, 97–125.
50) Itoh, K. & Fushiki, S. (2015) The role of L1cam in murine corticogenesis, and the pathogenesis of hydrocephalus. Pathol. Int., 65, 58–66.
51) Yamasaki, M., Nonaka, M., Suzumori, N., Nakamura, H., Fujita, H., Namba, A., Kamei, Y., Yamada, T., Pooh, R.K., Tanemura, M., et al. (2011) Prenatal molecular diagnosis of a severe type of L1 syndrome (X-linked hydrocephalus). J. Neurosurg. Pediatr., 8, 411–416.
52) Marin, O., Valiente, M., Ge, X., & Tsai, L.H. (2010) Guiding neuronal cell migrations. Cold Spring Harb. Perspect. Biol., 2, 1–21.
53) Cooper, J.A. (2013) Mechanisms of cell migration in the nervous system. J. Cell Biol., 202, 725–734.
54) Kaneko, N., Sawada, M., & Sawamoto, K. (2017) Mechanisms of neuronal migration in the adult brain. J. Neurochem., 141, 835–847.
55) Ruthel, G. & Banker, G. (1998) Actin-dependent anterograde movement of growth-cone-like structures along growing hippocampal axons: a novel form of axonal transport? Cell Motil. Cytoskeleton, 40, 160–173.
56) Allard, J. & Mogilner, A. (2013) Traveling waves in actin dynamics and cell motility. Curr. Opin. Cell Biol., 25, 107–115.
57) Veniere, S., Ampe, C., Vandekerckhove, J., & Lambrechts, A. (2009) The interaction of proline-rich ligands with profilin probed with an enzyme-linked immunosorbent assay. J. Biomol. Screen., 14, 350–359.
58) Sapir, T., Levy, T., Sakakibara, A., Rabinkov, A., Miyata, T., & Reiner, O. (2013) Shootin1 acts in concert with KIF20B to promote polarization of migrating neurons. J. Neurosci., 33, 11932–11948.
59) McNeely, K.C., Cupp, T.D., Little, J.N., Janisch, K.M., Shrestha, A., & Dwyer, N.D. (2017) Mutation of Kinesin-6 Kif20b causes defects in cortical neuron polarization and morphogenesis. Neural Dev., 12, 5.
60) Wang, Q., Wang, X., Le, Y., Jiang, M., Wu, J., Tao, L., Kang, Y., & Xiang, L. (2015) Rnaset2 inhibits melanocyte outgrowth possibly through interacting with shootin1. J. Dermatol. Sci., 80, 25–32.
61) Nawaz, M.S., Giarda, E., Bedogni, F., La Montanara, P., Ricciardi, S., Ciceri, D., Alberio, T., Landsberger, N., Rusconi, L., & Kilstrup-Nielsen, C. (2016) CDKL5 and shootin1 interact and concur in regulating neuronal polarization. PLoS One, 11, e0148634.
62) Sapir, T., Levy, T., Kozer, N., Shin, I., Zamor, V., Haffner-Krausz, R., McGlade, J.C., & Reiner, O. (2018) Notch activation by shootin1 opposing activities on 2 ubiquitin ligases. Cereb. Cortex, 28, 3115–3128.
63) Wang, Y., Sun, Y., Huang, Y., Pan, Y., Yin, A., Shi, B., Du, X., Ma, L., Lan, F., Jiang, M., et al. (2016) Validation of a genome-wide association study implied that SHTIN1 may involve in the pathogenesis of NSCL/P in Chinese population. Sci. Rep., 6, 38872.
著者紹介Author Profile
 稲垣 直之(いながき なおゆき)
稲垣 直之(いながき なおゆき)奈良先端科学技術大学院大学バイオサイエンス領域教授.医学博士.
略歴1986年大阪大学医学部卒,90年同大学院医学研究科博士課程修了.大阪大学医学部助手,マックスプランク精神医学研究所研究員,東京都老人総合研究所主任研究員,愛知県がんセンター研究所主任研究員,同室長,奈良先端科学技術大学院大学准教授を経て現職.
研究テーマと抱負細胞の形づくりのしくみ,特に,細胞移動,細胞極性形成,軸索ガイダンス,シナプス形成,アクチン波の分子メカニクスとロジックを解明し,医学の分野にも貢献することを目標にしています.
ウェブサイトhttp://bsw3.naist.jp/inagaki/
趣味水泳,ワイン,音楽鑑賞,絵画鑑賞.