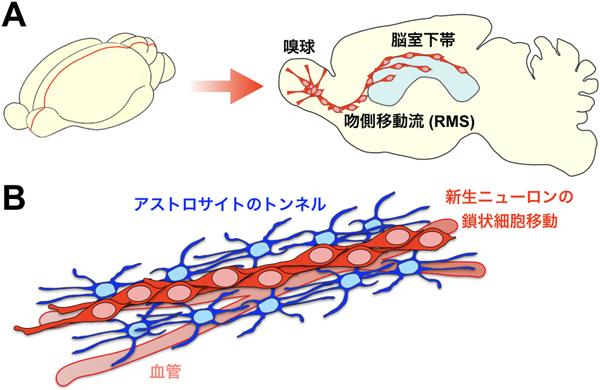
脳室下帯で産生されたニューロンは,RMSを通り,嗅球に向かって長距離を高速で移動する(図1).RMS内では,新生ニューロンは鎖状の細胞塊を形成しながら移動する4–6, 20).嗅球に到達すると,これらの細胞は鎖から脱離して単独で移動し,抑制性介在ニューロンに分化する5, 7).新生ニューロンの移動は,脳室下帯からの忌避シグナル,嗅球からの誘引シグナル,RMSにおける足場の働き,嗅球における移動停止機構の協調作用によって調節されている.
1)新生ニューロンの移動方向の制御
脳室下帯で産生されたニューロンの移動方向の決定には,忌避性シグナルが関わっている.我々は,側脳室外側壁に存在する上衣細胞の運動性繊毛の向きと新生ニューロンの移動方向が一致していることを見いだした21).上衣細胞の繊毛が形成されないTg737orpkマウスでは,脳脊髄液の流れが乱れ,脳室壁における新生ニューロンの鎖形成や移動方向も乱れた.これらの結果は,脳室内における上衣細胞の繊毛運動と脳脊髄液流が,Slitなど新生ニューロンの移動方向を決定するシグナル分子の分布に影響を及ぼしている可能性を示唆している.
一方,脳室周囲で産生されるSlitタンパク質が嗅球まで到達するとは考えにくいため,脳室壁を離れてRMS内を移動するニューロンが遠く離れた嗅球へ到達するためには別のメカニズムが必要である.嗅球組織と新生ニューロンを共培養すると新生ニューロンが嗅球組織に誘引されることから,嗅球から分泌される誘引因子の存在が示唆された22).実際に,HGF, BDNF, GDNF, Netrin-1, Prokineticin 2(PK2)など,嗅球で分泌される因子が新生ニューロンの誘引因子として働くことが報告された23–28).さらに,嗅球を外科的に除去しても,ニューロンが前方へ移動できる29)ことから,RMS内の局所的なシグナルが新生ニューロンの前方への移動に寄与している可能性も示唆されている.このように,生後脳における新生ニューロンの移動方向は,脳室下帯からの忌避シグナルと嗅球からの誘引シグナルによって決定されていると考えられる.
2)新生ニューロンの移動の足場
a.隣接する新生ニューロン
脳室下帯で産生されたニューロンは,鎖状の細胞塊を形成しながら移動する4–6, 20)(図1B).透過型電子顕微鏡を用いた解析によって,鎖を形成する新生ニューロンが接着結合(アドへレンス・ジャンクション)様構造を形成して互いに接着していることが明らかにされている30).鎖を形成する新生ニューロンにおいては,細胞間の接着を厳密に調節しながら,互いを足場として移動していると考えられる.
鎖を形成するニューロン間の接着結合様構造の分子実体はまだわかっていないが,これまでにいくつかの細胞接着分子が新生ニューロンの鎖状移動に重要な役割を果たすことが報告されている.PSA-NCAMは新生ニューロンに発現する細胞接着分子であり,ポリシアル酸残基が負に帯電することでNCAMどうしの接着を弱めると考えられている31, 32).酵素を用いたポリシアル酸残基の除去によって,脳室下帯から嗅球へのニューロン移動が阻害されることから,ポリシアル酸残基が効率的な鎖状移動に関与していることが示唆されている33).
N-cadherinは,カルシウム依存的な細胞接着分子であり,新生ニューロンに発現している34).N-cadherinのノックアウトマウスでは,脳室下帯において新生ニューロンの鎖形成が阻害されることから35),N-cadherinが新生ニューロンの鎖形成や嗅球への移動に重要であることが示唆されている.さまざまな上皮組織においてcadherinは接着結合の主要な構成因子であることが知られているが,新生ニューロン間の接着結合様構造の形成や維持にN-cadherinが関与しているかどうかはわかっていない.
新生ニューロンどうしの接着を促進するホモフィリック結合分子に加えて,新生ニューロンと細胞外マトリックスの相互作用も鎖状のニューロン移動に関与している.RMSにはLamininやTenascin-Cなどの細胞外マトリックスが濃縮している36).一方で,Lamininの受容体であるα6β1-integrinやβ8-integrinは新生ニューロンに発現している37–39).これらのノックアウトマウスでは,RMSにおける新生ニューロンの鎖形成が異常になり,嗅球への移動が障害される37, 39).培養条件下において,新生ニューロンはLaminin依存的に鎖を形成するのに対し,β1-integrin遺伝子を欠損したニューロンでは鎖形成が観察されず,移動速度も遅いことから,Laminin-integrinシグナルが鎖形成およびニューロン移動に重要であることが示唆されている40).細胞外マトリックスの調節因子であるADAM2も新生ニューロンの鎖状移動に関与することから41),細胞外マトリックスの適切な調節が新生ニューロンの鎖状移動を実現していると考えられる.
細胞接着の制御に加えて,細胞の動きや形態の調節も新生ニューロンの鎖状移動に重要な役割を果たしている.鎖状で移動する新生ニューロンは,移動期と休止期を繰り返しながら跳躍的に移動する.我々は,移動する新生ニューロンにおけるRac1の活性をFRETイメージングを用いて可視化し,休止期の新生ニューロンがRac1活性化により自身の細胞体を凹ませることで,移動期の新生ニューロンのための通り道を作るメカニズムを明らかにした42).また,新生ニューロンの移動を調節することが知られていたアクチン結合タンパク質Girdin43)に着目し,その結合タンパク質を網羅的に探索した結果,RhoGAPタンパク質Gmipを同定した44).Gmipは新生ニューロンにおいて,先導突起基部のRhoA活性を負に調節することで,跳躍移動を調節することを明らかにした.RhoAの下流因子の一つであるmDia45)も新生ニューロンの跳躍移動を調節することから,新生ニューロンにおける時空間的な細胞骨格制御が,効率のよい鎖状移動に貢献していると考えられる.
このように,いくつかの分子が新生ニューロンの鎖状移動に関与していることが報告されているが,それらがどのように効率のよい鎖状移動を制御するかはいまだに多くの点で不明である.RMSという非常に狭い空間の中を,どのようにして多くの新生ニューロンが効率よく移動していくかを明らかにするためには,時空間的な細胞間接着や形態変化の制御機構をさらに明らかにする必要がある.
b.アストロサイト
脳室下帯のアストロサイトは,神経幹細胞として働いて新生ニューロンを産生するとともに46, 47),その突起を新生ニューロンの鎖と平行に伸ばして,トンネル状の構造物を形成し,移動する新生ニューロンを取り囲んでいる6, 48)(図1B).アストロサイトのトンネルは,げっ歯類では生後3週間で形成される36, 49).このトンネルは,周囲の神経回路や脳実質から移動する新生ニューロンを隔離する役割を担う.アストロサイトのトンネル形成が異常になる変異マウスでは,新生ニューロンの移動も異常になることが報告されており48, 50, 51),アストロサイトトンネルがニューロン移動に重要な役割を果たすと考えられている.
さらに,嗅球に到達したニューロンを脳室下帯に移植すると再びRMSを通って嗅球まで移動できる52)ことから,アストロサイトトンネルはニューロンに未熟な状態を維持させて長距離移動を可能にする,特殊な環境を形成しているとも考えられる.たとえば,アストロサイトはGABA輸送体であるGAT4を発現して,余分な細胞外GABAを取り込む.GABAは移動する新生ニューロンから放出され,GABAA受容体を介して新生ニューロンの移動を抑制するため,アストロサイトによるGABAの取り込みによってニューロンの移動が促進される53).また,アストロサイト由来のグルタミン酸は移動する新生ニューロンの生存を促進している54).さらに,アストロサイトが発現するephrin-B2/B3もその受容体であるEphA/Bを介して新生ニューロンの増殖や移動を調節している55, 56).
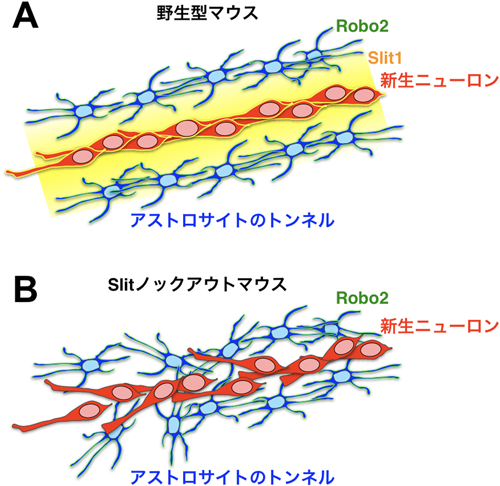
我々は,RMSにおける新生ニューロンとアストロサイトの相互作用には,反発性ガイダンス分子であるSlitとRoboが重要な役割を果たしていることを明らかにした48)(図2).RMSを移動する新生ニューロンはSlit1を分泌し,その受容体であるRobo2が周囲のトンネルを形成するアストロサイトに発現している(図2A).Slit1ノックアウトマウスを解析した結果,アストロサイトのトンネル構造が乱れ,ニューロン移動が障害されていた(図2B).さらに,アストロサイトのトンネル構造の維持における新生ニューロンの重要性を調べるために,細胞増殖阻害剤であるAraCを脳に投与して新生ニューロンを除去した結果,アストロサイトのトンネル構造が乱れることが明らかになった.これらの結果から,Slit-Roboシグナルがアストロサイトの分布や形態を調節することでトンネル構造を制御し,成体脳における新生ニューロンの移動経路を維持していることが明らかになった.
このようにアストロサイトのトンネル形成・維持に関するメカニズムは明らかになりつつあるが,新生ニューロン移動におけるこの構造の意義は十分に解明されていない.げっ歯類6)や霊長類57–59)では,アストロサイトのトンネルが新生ニューロンを囲んでいるのに対し,ゼブラフィッシュ60–62)やウサギ63)ではその存在が観察されていない.したがって,アストロサイトのトンネルを持つ種と持たない種のニューロン移動を比較することで,その意義を明らかにすることができるかもしれない.
c.血管
脳室下帯から嗅球に至る移動経路において,新生ニューロンは血管に沿って移動していることが報告されており64, 65),血管がニューロン移動の足場として働くことが示唆されている(図1B).新生仔期の発達過程において,RMS周囲のアストロサイトがVEGFを分泌し,ニューロンの移動方向と並行した血管の形成を誘導する49).一方,形成された血管の内皮細胞がBDNFを分泌し,血管を被覆するアストロサイトがそれらを細胞膜上に提示することで,新生ニューロンの血管に沿った移動を調節していると考えられている64).
血管に沿ったニューロン移動のメカニズムはまだ多くの点で不明である.さらなるメカニズムの理解のためには,アストロサイトや周皮細胞などの血管構成細胞と新生ニューロンの相互作用をより正確に理解する必要がある.また,血管へ直接接着せずに,血管と並行に移動するニューロンも多く存在することから,血管周囲の空間は細胞が移動しやすいのかもしれない.生後の脳は血管網が発達しているため,血管を足場とする新生ニューロンの移動は,確実に目的地へ到達するための合理的な戦略と考えられる.
3)新生ニューロンの移動停止
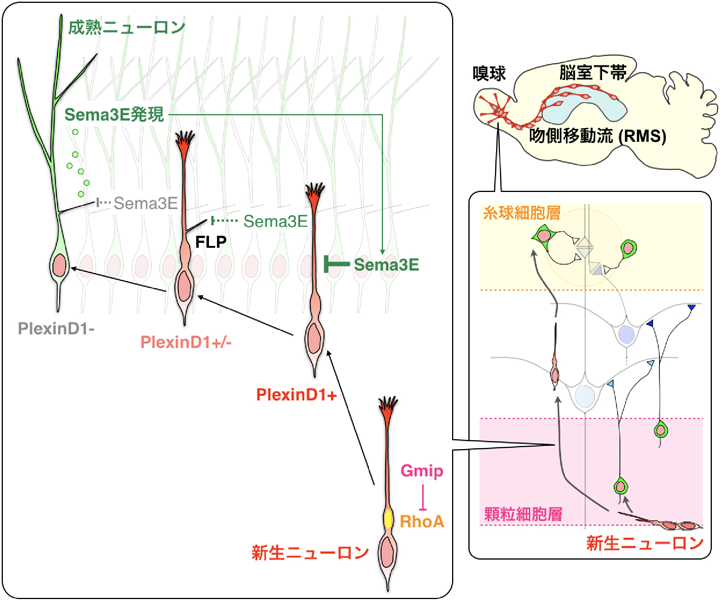
嗅球に到達した新生ニューロンは,鎖状の細胞塊から離脱して単独で嗅球の中を移動し,顆粒細胞層もしくは糸球細胞層でそれぞれ顆粒細胞および傍糸球細胞へと分化する5, 7)(図3).新生ニューロンの移動停止位置を変化させると,嗅球における新生ニューロンの樹状突起パターンや機能が変化することから52, 66, 67),嗅球における新生ニューロンの移動停止過程の調節は,嗅球の神経回路形成や機能に影響すると考えられる.
ReelinやPK2, Tenascin-Rは,培養した新生ニューロンの鎖からの脱接着を促進することが報告されている26, 68, 69).さらに,これらのノックアウトマウスでは,新生ニューロンが嗅球に到達すると凝集してしまうことから,これらの分子が新生ニューロンの脱接着シグナルとして働くと考えられている.興味深いことに,ReelinやTenascin-Rの発現は嗅覚入力の影響を受けることから69, 70),ニューロンの脱接着は嗅覚入力依存的に調節されていると考えられる.
鎖を形成する新生ニューロンの脱接着過程では,細胞間接着が減少していくと推測されていた.我々は最近,電子顕微鏡解析によって,嗅球における脱接着の際に新生ニューロン間の接着結合様構造が減少するが,Reelinの下流因子Dab1の変異マウスでは減少しないことを報告した71).さらにこの分子メカニズムとして,Reelin-Dab1シグナルと非受容体型チロシンキナーゼFynが協調して新生ニューロンの脱接着を調節していることを明らかにした.この他にも,sphingosine 1-phosphate receptor 1はRMSを移動する新生ニューロンに発現するが,嗅球に入ると減少し,NCAMやβ1-integrinを減少させることで新生ニューロンを鎖から離脱させることが報告されている72).このように,嗅球で発現する脱接着シグナルが新生ニューロン間の接着構造を弱めることによって,新生ニューロンが効率よく鎖から脱接着できるようになると考えられている.
我々は,RMSや嗅球における新生ニューロンの移動がGmipによるRhoA活性の調節によって負に制御されており,ニューロン移動の速度調節が嗅球における最終停止位置に影響を与えることを報告した44)(図3).PlexinB2もRMSから嗅球に至る新生ニューロン移動を抑制することが報告されており73),これらの分子が移動のブレーキの役割を果たしていると考えられる.さらに最近我々は,嗅球における新生ニューロンの移動停止過程では,新生ニューロンが先導突起の基部から側方に特殊な突起を形成することを見いだし,これをfilopodium-like lateral protrusion(FLP)と命名した52)(図3).PlexinD1は移動する新生ニューロンの先導突起に発現する一方,リガンドであるSema3Eは嗅球の成熟介在ニューロンで発現していた.Sema3Eはその反発作用によって新生ニューロンのFLP形成を抑制し,未熟な形態を維持することで,新生ニューロンの最終停止位置や機能を調節することを明らかにした.
RMS内とは異なり,嗅球内で移動停止が近づいた新生ニューロンは,成熟した神経回路網の中を単独で移動する必要がある.この過程では,血管74)などの足場を利用しながら,神経伝達物質75, 76)を介したサポートを受けて最終目的地に到達し,分化・成熟する.このような神経活動依存的なメカニズムは,外界の匂い環境の変化に応じた神経回路の再編成に関与していると考えられる.
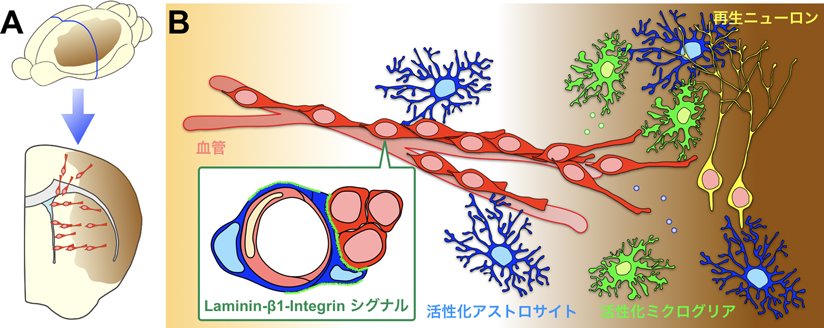
脳梗塞や神経変性疾患などをはじめとするさまざまな脳障害によって,脳室下帯のニューロン新生が影響を受けることが知られている.特に,脳梗塞が生じると,脳室下帯の神経幹細胞から産生された新生ニューロンが傷害領域に移動し,一部が成熟する14–16)(図4)ことから,脳室下帯で産生された新生ニューロンが内在的な神経再生や機能回復に貢献する可能性が期待されている.一方,傷害を受けた線条体では,ニューロンがその場で産生されるという報告もある77).これまでに,新生ニューロンの傷害部位への移動における足場や方向性の制御メカニズムが報告され,正常脳におけるメカニズムとの共通点や相違点が明らかになりつつある.
1)新生ニューロンの移動方向の制御
傷害後の脳組織では,大規模な神経細胞死とともに,血管網の破綻や炎症反応の活性化が生じる.上述したとおり,正常脳では脳室下帯で産生されたニューロンの移動経路はRMS内に限られているが,脳組織が傷害を受けると線条体や大脳皮質など脳室周囲の他の領域へ移動できるようになる.このような移動方向の変化には,炎症によって活性化した細胞群が分泌する誘引因子が重要な役割を果たすと考えられている.
SDF1やAng1は脳梗塞後に血管内皮細胞から分泌される.一方,新生ニューロンはそれらの受容体であるCXCR4やTie-2を発現し,SDF1やAng1に誘引されて傷害部位へと移動する78–81).同様に,MCP1やCXCL13は反応性アストロサイトや活性化ミクログリアから放出される82, 83).これらの受容体であるCCR-2やCXCR-5のノックアウトマウスでは,傷害部位へのニューロン移動が観察されないことから,これらのケモカインも新生ニューロンの誘引因子として働くことが示唆されている.
RMSでは新生ニューロンが嗅球へ向かって一方向性に移動する一方,傷害脳を移動する新生ニューロンの方向性は不安定である79, 84, 85).脳内のガイダンスシグナルや後述する足場など,細胞移動をサポートする脳内環境が不十分であることが,傷害部位へのニューロン移動の効率を低下させていると考えられる.
2)新生ニューロンの移動の足場
a.隣接する新生ニューロン
脳室下帯から傷害部位へ移動する新生ニューロンは,RMSと同様に鎖状の細胞塊を形成し,接着結合様構造を介して互いに接着している.傷害脳で鎖を形成して移動する新生ニューロンはβ1-integrinを発現している40).新生ニューロン特異的なβ1-integrinノックアウトマウスでは,接着結合様構造の形成や鎖状のニューロン移動が阻害されることから,傷害脳における鎖状のニューロン移動にβ1-integrinが関与することが示唆されている(図4B).RMSで新生ニューロン間の接着を調節するPSA-NCAM33, 51, 86)やN-cadherin34, 35)などの細胞接着分子が,傷害脳でどのような機能を有しているかはまだわかっていない.
b.アストロサイト
傷害を受けた脳では,アストロサイトは急速に活性化し,形態や遺伝子発現を変化させる.このような反応性アストロサイトは,傷害部位における瘢痕形成や炎症反応に関与し,神経傷害性および神経保護性の両方の性質を示すことが知られている87).成体大脳皮質の傷害モデルでは,反応性アストロサイトの突起に新生ニューロンが沿うことが報告されている88)ことから,アストロサイトの突起が移動の足場になる可能性がある.RMSでは,アストロサイトのトンネルが移動する新生ニューロンを周囲の脳実質から物理的に隔離して,移動に適した環境を提供すると考えられているが,傷害脳の新生ニューロンの移動における反応性アストロサイトの役割は明らかにされていなかった.
我々は最近,成体マウスの脳梗塞モデルにおいて,反応性アストロサイトが新生ニューロンの移動を阻害することを報告した89).脳梗塞後の線条体では,新生ニューロンはSlit1を分泌し,Robo2を発現する反応性アストロサイトを反発して移動するが,徐々にSlit1の発現が低下することでその移動能力が低下する.Slit1を過剰発現させた新生ニューロンを移植すると,脳梗塞でダメージを受けた外側線条体まで移動して,線条体から淡蒼球へ投射するニューロン(中型有棘細胞)を再生し,歩行機能の障害を回復させる.したがって,脳梗塞後の機能的再生のためには,移動の障害となる反応性アストロサイトを制御して,新生ニューロンを適切な部位に配置することが重要であると考えられる.
c.血管
傷害脳のスライス培養実験において,新生ニューロンが血管から血管へ飛び移ることや,血管分岐点で反転することが報告されている79, 84, 85).これらの観察から,血管は新生ニューロンが傷害部位へと移動するための重要な足場であると考えられている.
新生ニューロンは,アストロサイトのエンドフィートによる被覆を介して新生血管と既存血管の両方に沿っている16, 79).RMSにおける血管に沿ったニューロン移動と同様に,傷害脳でも,アストロサイトが血管内皮細胞由来のBDNFを捕捉して新生ニューロンに提示することで,傷害部位への血管に沿ったニューロン移動に関与している64, 84).我々は,β1-integrinが新生ニューロンどうしの接着だけでなく,血管に沿った新生ニューロンの移動も制御していることを報告した(図4B).新生ニューロン特異的なβ1-integrinノックアウトマウスでは,血管に沿った移動速度が遅くなることから,新生ニューロンは血管周囲の細胞外マトリックスを認識することで,効率よく血管に沿って移動すると考えられる40).今後の研究によって,足場としての血管の役割の理解が深まることが期待される.
d.放射状グリア
放射状グリアは,発生期に脳室面に存在する神経幹細胞であり,細い突起を脳表に伸ばして極性化した形態を示す90).放射状グリアから産生された新生ニューロンは,その突起を足場として用いて,脳表へ向かって移動する.魚類60, 62),爬虫類91–93),鳥類94, 95)などの下等な脊椎動物では,成体脳でも放射状グリアが維持されており,その突起に沿って新生ニューロンが移動する.一方で,哺乳類では,放射状グリアは出生直後に上衣細胞や神経幹細胞へ分化して消失する2, 96–100).興味深いことに,放射状グリアから上衣細胞への分化は,老齢期のゼブラフィッシュ脳室面でも観察される101)ことから,放射状グリアの分化の仕組みは進化的に保存されており,種によってそのタイミングが異なると考えられる.
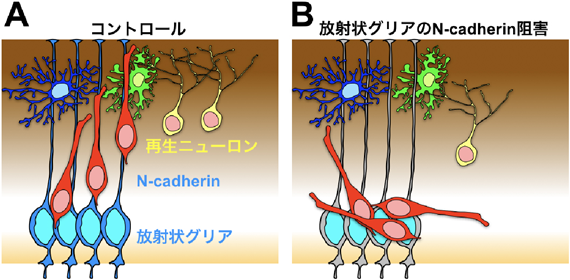
我々は,げっ歯類において,新生仔期に脳外傷や低酸素虚血性脳症などの脳傷害が生じると,放射状グリアが生後においても一定期間維持されることを見いだした102)(図5A).脳室下帯で産生された新生ニューロンは,N-cadherinを介して放射状グリアの突起に沿って傷害を受けた大脳皮質へと移動する.放射状グリアにN-cadherinドミナントネガティブ変異体を発現させると,放射状グリアの突起に沿ったニューロン移動および再生が阻害される(図5B).これらのことから,哺乳類の脳は,脳傷害に反応してニューロンの移動の足場を維持し,ニューロンを再生させる潜在的な能力を有していると考えられる.
成体脳においても,脳梗塞モデル103)やErbB2の恒常活性化変異体を過剰発現するマウス104)では,放射状グリア様の形態を持った細胞が出現し,移動の足場になりうることが示唆されている.これらをさらに解析することにより,傷害後に放射状グリアが維持・出現するメカニズムや新生ニューロンとの相互作用メカニズムの解明につながるかもしれない.
4. 新生ニューロンの移動促進による脳傷害後の神経再生
上述のように,傷害脳における新生ニューロンの移動は,足場と誘引因子によって調節されている.正常脳に比べて,傷害脳における新生ニューロンの移動効率が悪いことを考慮すると,脳傷害で失われた神経細胞を再生するためには,足場や誘引因子を用いてニューロン移動を促進する必要がある.近年,これらのメカニズムを利用したバイオマテリアルによる新生ニューロンの移動促進が,傷害後のニューロン再生のみならず障害された脳機能の回復に貢献することが報告されている(図6).
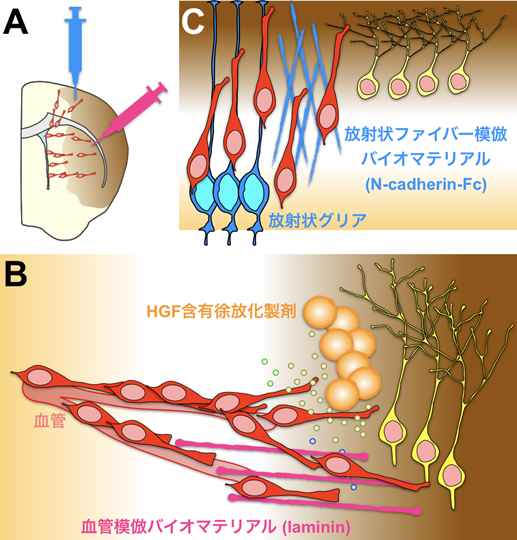
新生ニューロンの移動を促進する因子を傷害脳に投与する場合,その有効濃度を長期間維持することが鍵となる.しかし,血中への投与では血液脳関門が障壁となり,脳実質への連続投与は技術的な困難が生じるため,新たな投与方法が望まれていた.最近,徐放化製剤がこの問題点を解決する方法の一つとして着目されている.たとえば,GDNFを徐放化製剤に封入して脳室下帯へ注入すると新生ニューロンの移動を促進することが報告されている105).我々は,HGFを含有させた徐放化製剤を脳梗塞後の線条体へ注入すると,傷害部位へ移動する新生ニューロンの数が増加することを明らかにした106)(図6B).このように,新生ニューロンの移動を促進することが報告されている因子を徐放化製剤に含有させて投与することで,傷害脳領域の適切な場所により多くの新生ニューロンを誘導することが可能になるかもしれない.
新生ニューロンの移動のための足場を提供することも,ニューロン再生戦略の一つである.新生ニューロンはアストロサイト,血管,および放射状グリア細胞を足場として利用していることから,これらの形状を模倣し,相互作用分子を付加するなどの工夫を施したバイオマテリアルが作製されている.実際に,ポリε-カプロラクトン(PCL)を電界紡糸したマイクロファイバーにBDNF類似体を結合させて脳に注入すると,新生ニューロンの線条体への移動が促進することが報告されている107).また,PCLをグラフェンで覆うバイオマテリアルも,新生ニューロンの移動を促進する108).
我々は,新生ニューロンが足場として利用する血管や放射状グリア細胞に着目し,その相互作用分子に着目したバイオマテリアルを用いて,ニューロン再生に与える効果を研究してきた.たとえば,血管の構成成分であるLamininを用いたスポンジやインジェクタブルゲルは,傷害部位への新生ニューロンの移動を促進する40, 109)(図6B).同様に,放射状グリア細胞に沿ったニューロン移動に用いられるN-cadherinをコートしたスポンジも,新生仔傷害モデルにおいてニューロン移動を促進する102)(図6C).さらにN-cadherinスポンジは,傷害を受けた大脳皮質で再生したニューロンの数を増加させ,傷害によって悪化した歩行機能を回復させることを明らかにした.ニューロンの人工足場を移植するだけでなく,血管新生を促進して内在的な足場を形成させるバイオマテリアル110)も開発されている.足場素材を侵襲なく脳内に注入する技術など,臨床応用のためには多くの課題が残されているが,これらのマテリアルを使用することによって傷害脳における新生ニューロンの移動および再生を促進することが可能になっている.
脳室下帯のニューロン新生の調節メカニズムは,主にげっ歯類を用いて研究されてきたが,近年の研究で,魚類からヒトを含む霊長類まで進化的に広く保存されていることがわかっている17–19).このことから,脳室下帯のニューロン新生や産生されたニューロンの移動は,生物学的に重要な生命現象であると考えられる.また,脳傷害後のニューロン移動の仕組みがヒトにも保存されているとすれば,脳疾患の再生医療に役立つことも期待できる.
旧世界ザルであるマカク属の脳では,新生ニューロンが鎖を形成し,アストロサイトの突起で形成されたトンネルを通って嗅球へ移動することが報告されている57–59).新生ニューロンの鎖は,嗅球に近づくにつれて不連続になるが,ブロモデオキシウリジン投与で標識された新生細胞は3か月後に嗅球で成熟ニューロンのマーカーを発現する58).これらの結果から,脳室下帯で産生された新生ニューロンは嗅球まで移動して成熟することが示唆されている.
新世界ザルに属するコモンマーモセットは,最近,神経科学研究の新たなモデル動物として普及しつつあり,生後脳の脳室下帯におけるニューロン新生の研究にも用いられている111–113).我々は,マーモセット脳が,ヒトとよく似た脳室下帯の構造を持ち,産生されたニューロンが鎖状の細胞塊を形成してRMSを通って嗅球へ向かうことを明らかにした113).また,この新生ニューロンの鎖状移動は新生仔期には明確に観察されるが,成体脳では減少することがわかった.さらに,新生仔期の脳室下帯組織を培養すると,鎖を形成して移動する新生ニューロンが観察された.このように,霊長類でもげっ歯類と同様の新生ニューロンの移動メカニズムが保存されていると考えられている.
ヒトにおいても,成人嗅球において未熟なニューロンのマーカーを発現する細胞が観察されることが報告されていた114, 115).しかし,最近の研究では,ヒト脳室下帯の増殖細胞や新生ニューロンの数は出生後数か月で急激に減少し,成人の脳室下帯におけるニューロン新生能は,成体マーモセットと同様にきわめて低いと考えられている116–120).未熟なニューロンのマーカーを発現する細胞は,脳梗塞を起こした成人の死後脳でも観察されている121–124)が,これらの細胞が脳室下帯で産生されて傷害部位へ移動してきたのか,ヒト正常脳で報告されているように,その場で産生されたのか125)はわかっていない.
一方で,ヒト新生児脳では,脳室下帯で産生された新生ニューロンはRMSを通って嗅球へと移動するだけでなく,medial migratory stream(MMS)と呼ばれる移動経路を通って前頭前野へも移動することが報告されている119, 120).さらに最近では,出生直後の側脳室周囲には,新生ニューロンが鎖状の細胞塊を形成して血管と密に接触することや,これらの細胞が大脳皮質へ広範に移動することが報告されている126).新生仔マウスの脳傷害モデルでは,脳室下帯のニューロン新生が神経再生や歩行機能の回復に貢献する102, 127, 128)ことから,ヒト新生児脳における脳室下帯のニューロン新生も,低酸素性虚血性脳症をはじめとする周産期脳傷害に対する内在性神経再生の有力なソースになると考えられる.