1)EF-hand
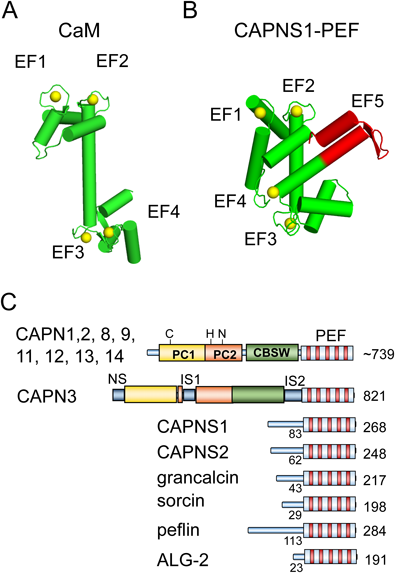
EF-handの名前は,筋肉中に存在するパルブアルブミン(parvalbumin)のX線結晶構造解析から明らかとなったCa2+結合モジュールの構造に由来する.αヘリックスEとαヘリックスFの間のループにCa2+が結合するが,二つのαヘリックスをそれぞれ突き出した親指と人差し指,そしてループを握りしめたその他の指になぞらえたことによる7).このような約30アミノ酸残基からなるヘリックス–ループ–ヘリックスを持つEF-handおよびEF-hand様構造はタンパク質分子内に単独で存在する場合もあれば,多数繰り返して存在する場合もある8).一般に,二つのEF-handは,ループ後半で逆平行βシートを形成し,さらにそれぞれ3残基からなる二つの疎水性クラスターが安定構造形成に寄与して,空間的にひとかたまりとなる9).最もよく知られているEF-handタンパク質であるカルモジュリン(calmodulin:CaM)は,四つのEF-handを持ち,N末端側とC末端側でそれぞれ二つのEF-handから形成されたローブ(葉状のかたまり)を持つ(図1A).
2)penta-EF-hand構造の特徴
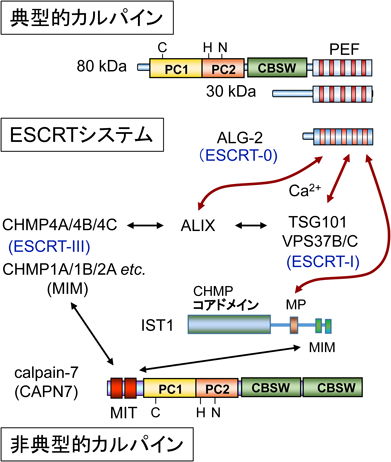
Ca2+依存性プロテアーゼであるカルパイン(calpain)の大小サブユニットは,1980年代半ばに一次構造が明らかにされ,ともにCaM様の四つのEF-handを持つと推定されていた10, 11).しかし,1997年,小サブユニットのCa2+結合ドメインのX線結晶構造解析の結果,予想に反して五つのEF-hand構造を持つことが明らかとなった12, 13).推定されていたCa2+結合領域のN末端側にさらにもう一つEF-hand構造が見つかった(図1B).規範的なEF-hand配列と比較すると,カルパイン大小サブユニットの新しく命名されたEF1領域は,Ca2+結合ループ内に1残基の欠損があった.また,Ca2+が配位する重要な酸素原子を持つアスパラギン酸残基がアラニンに置換されていた.このため,EF1はモチーフ検索でEF-handとは予測されていなかった.結晶構造においてCa2+は,置換残基であるアラニンのカルボニル基の酸素原子に配位していた.一方,C末端に位置する5番目のEF-hand(EF5)はホモ二量体の相手分子のEF5とペアとなり,二量体形成部位となっていた.カルパインの小サブユニットには他にもCaMと比較して異なる点が見いだされた.①八つのαヘリックスから構成され,EF2とEF3の間,EF4とEF5の間は連続したαヘリックスを共有している.②EF2-EF3を結ぶリンカーはCaMの場合柔軟であるが,7残基短いためEF2とEF3が接近し,全体としてコンパクトになっている.③EF3とEF4が閉じた格好になっている.④EF1とEF2の間のループが長い.筆者らはこのような特徴的な構造を持つ五つのEF-hand構造(~170アミノ酸残基)をpenta-EF-hand(略称PEF)と命名した14).
3)PEFファミリー
プロテアーゼドメインを持つカルパイン大サブユニットと相同な遺伝子はヒトゲノム中に15存在し,遺伝子記号はCAPNとこれに続く数字で表記される(例,CAPN1)15).そのうちPEFドメインを持つものは九つ存在する(図1C).組織普遍的に存在して,in vitroでの活性測定時のCa2+要求濃度がμMオーダーであるμ-カルパイン(大サブユニット遺伝子記号CAPN1),mMオーダーであるm-カルパイン(大サブユニット遺伝子記号CAPN2)は,共通の小サブユニットを持つ(遺伝子記号CAPNS1,以前の表記はCAPN4).また,小サブユニット相同遺伝子CAPNS2は,イントロンを持たないが組織特異的な発現が確認されている16).その他,PEFファミリーにはプロテアーゼドメインを持たないサブファミリーも存在する.哺乳類ではEF1がカルパイン大小サブユニットと類似したsorcin(遺伝子記号SRI)やgrancalcin(遺伝子記号GCA),そしてEF1にも欠損残基や重要なアミノ酸残基の置換もないALG-2(遺伝子記号PDCD6)や全領域でALG-2と類似性が高いpeflin(遺伝子記号PEF1)が存在する(図1C)17).ALG-2は,1996年に免疫系細胞におけるアポトーシス関連遺伝子産物として発見された18).その後,ALG-2遺伝子のノックアウトマウスが作出されたが,対照マウスと比較して免疫系やその他の器官・組織・細胞に異常が観察されなかった19).しかし,近年,ヒトにおいて悪性腫瘍とALG-2遺伝子(PDCD6)の発現異常との関連を示唆する報告が蓄積しつつあり,ALG-2は,がんのバイオマーカーとして注目され出している20–23).ALG-2ホモログは原生生物や酵母,カビ,植物にも存在し,進化的に真核生物において広く保存されている24).これに対して,PEFドメインを持つ典型的カルパインやsorcin, grancalcinは下等真核生物には存在しない(表1).μ-カルパインやm-カルパインなど組織普遍的に存在する典型的カルパインは,一般に大小サブユニットがヘテロ二量体を形成する.カルパイン以外のPEFファミリーメンバーについても,生化学的解析によって二量体形成が報告されている.ALG-2の場合は,ホモ二量体および近縁のpeflinとヘテロ二量体を形成する25).また,Ca2+依存的膜結合性もPEFタンパク質の共通した性質である25–29).PEFドメインのN末端側に存在するグリシン,プロリン,アラニンなどに富んだ疎水性領域が関与していると推察されるが,配列の進化的保存性は低い17).ALG-2のEF5にはCa2+が結合するが通常の配位とは異なり30),むしろMg2+が生理的濃度で結合することにより二量体を安定化し,EF1とEF3へのCa2+の結合能が高くなると報告されている31–33).配列比較からCAPN1とCAPN8のPEFもMg2+が結合すると予測されている32).
表1 生物界におけるPEFタンパク質分布| PEFタンパク質とカルパイン | 原生生物 | 植物 | 酵母 | カビ | 線虫 | ハエ | 哺乳類 |
|---|
| PEFタンパク質 | | | | | | | |
| ALG-2/PEF* | + | + | + | + | + | + | + |
| peflin | — | — | — | — | — | + | + |
| 典型的カルパイン | | | | | | | |
| (大サブユニット) | — | — | — | — | — | + | + |
| (小サブユニット) | — | — | — | — | — | — | + |
| sorcin | — | — | — | — | — | — | + |
| grancalcin | — | — | — | — | — | — | + |
| calpain-7 | | | | | | | |
| (PalB/Rim13) | — | — | + | + | + | — | + |
| *ALG-2ホモログの名称は生物によって異なり,機能は下等真核生物や植物と哺乳類とでは異なる. |
CaMはCa2+と結合してさまざまな標的タンパク質と結合する.代表的な例としては,N末端側とC末端側のローブが特定のCaM認識モチーフを含む標的ペプチドヘリックスと結合する際,標的を取り囲むように大きく立体配置を変化させる34).また,IQモチーフのように,Ca2+依存的・非依存的に結合するケースもある35).PEFタンパク質の場合にもCa2+依存的だけでなく,非依存的に結合する標的タンパク質も報告されている.しかし,Ca2+センサーとしてのPEFタンパク質の機能を理解するためには,Ca2+依存的な結合あるいは解離が重要となる.
1)カルパインPEF
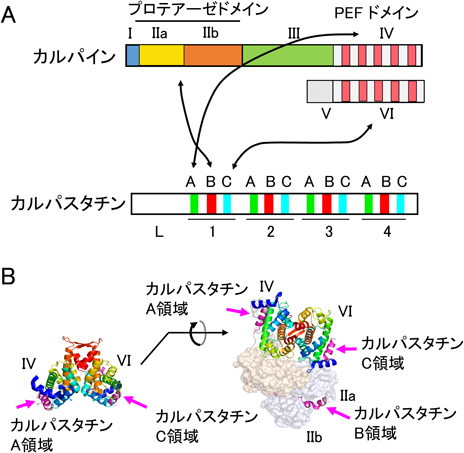
カルパスタチン(calpastatin)はμ-カルパインやm-カルパインの内因性阻害タンパク質であり,阻害ドメインを分子内に4回繰り返し持つ(図2A,下段)36, 37).組織特異的な選択的スプライシングや転写開始点の違いがあり,分子多様性がある38, 39).繰り返しドメイン間で保存された三つの領域(A, B, C)は別々のエクソンにコードされ39),A領域とC領域のアミノ酸配列は相互に類似している40).B領域が阻害中心であるが,A, C領域が阻害を増強させている41–43).A領域は大サブユニットのPEFドメイン(当時の名称はCaM様ドメイン),C領域は小サブユニットのPEFドメイン(CaM様ドメイン)にそれぞれ特異的にCa2+依存的結合することが1990年代半ばごろまでに生化学的解析によって明らかにされた42–44).2000年代になって,カルパインとカルパスタチン複合体のX線結晶構造解析が行われ,このような3部位結合モデルが正しいことが証明された(図2B)45–47).また,カルパスタチン以外にも,Rhoグアニンヌクレオチド交換因子(αPIX,別名ARHGEG6)48),Ras GTPase活性化因子(RasGAP)49),ホスホイノシチド3-キナーゼ(PI3K)50)が小サブユニットと相互作用すると報告されている(表2).その相互作用が小サブユニットのPEFドメインなのか,N末端非PEF領域なのかは不明であり,Ca2+の要求性など結合の特性は明らかにされていない.相互作用の生理的意義は不明であるが,小サブユニットは大サブユニットとヘテロ二量体を形成するため,細胞内では,小サブユニットとの結合により相互作用タンパク質や複合体周辺部のタンパク質が基質となっている可能性がある.しかし,カルパイン小サブユニットが大サブユニットに依存せず,単独で何らかの生理機能を持つ可能性は否定できない.
表2 PEFタンパク質の機能と主な相互作用因子の一覧| PEFタンパク質の名称 | ヒト遺伝子記号 | 主な生理機能 | 報告されている主な相互作用因子* |
|---|
| カルパイン小サブユニット | CAPNS1 | 大サブユニット(CAPN1, CAPN2)とヘテロ二量体形成 | カルパスタチン,αPIX, RasGAP, PI3K |
| sorcin | SRI | Ca2+恒常性調節,シグナル伝達,細胞死,細胞分裂 | AnxA7, AnxA11, NCX, RyR, SERCA, L型電位依存性Ca2+チャネル,プレセニリン2, PLK1, ChREBP |
| grancalcin | GCA | 白血球機能調節 | L-プラスチン |
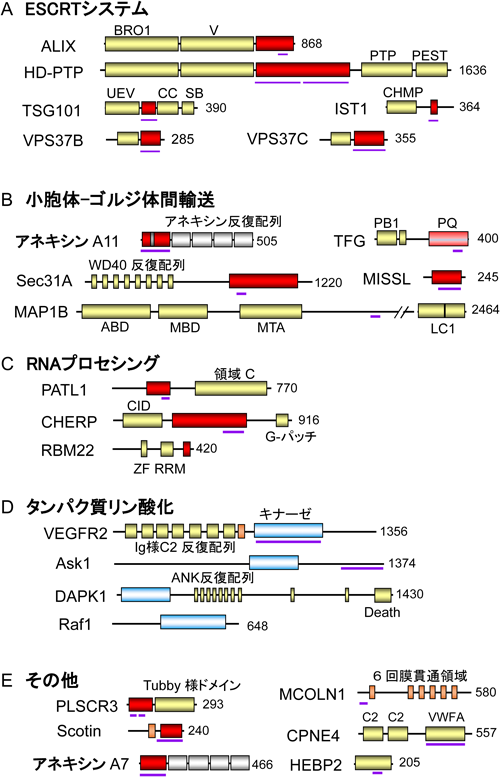
| ALG-2 | PDCD6 | 細胞死,ESCRTシステム補助機能,小胞体–ゴルジ体間輸送調節,RNAプロセシング,細胞分裂,シグナル伝達 | ALIX, TSG101, VPS37B, VPS37C, IST1, Sec31A, TFG, MAP1B, MISSL, CHERP, PATL1, RBM22, AnxA7, AnxA11, HEBP2, VEGFR2, PLSCR3, Scotin, MCOLN1, Ask1, Raf1, CPNE4 |
| peflin | PEF1 | ALG-2とヘテロ二量体形成,ユビキチン修飾 | TRPN1, KLHL12 |
| *略号は本文中における各PEFタンパク質の節を参照. |
2)sorcin
sorcinはがん細胞において多剤耐性輸送体(MDR1)に付随して増幅する遺伝子として,1986年に発見されたが51),その生理機能は多様であり,Ca2+恒常性調節やシグナル伝達52),細胞死53),細胞分裂54)などへの関与が報告されている.ノックアウトマウスは膵β細胞からのインスリン分泌が低下し,また心室不整脈を引き起こすが,いずれもCa2+恒常性異常によると考えられている55, 56).sorcinと相互作用するタンパク質もいくつか報告されている.アネキシンはCa2+依存性リン脂質結合タンパク質であり57),ヒトでは12のメンバー(遺伝子ANXA1~ANXA13,ただしANXA12は欠番)が存在している.アネキシンA7およびA11は,アネキシンファミリーの中でも特徴的なN末端側に長い(~180残基)制御領域を持っている.sorcinはこの制御領域のN末端領域にCa2+依存的に結合するが,GYPPモチーフの繰り返しが重要と考えられている58).sorcinはNa+–Ca2+交換因子(NCX)59),リアノジン受容体(RyR)60),筋小胞体Ca2+-ATPase(SERCA)61),L型電位依存性Ca2+チャネル62),プレセニリン263)やPolo様キナーゼ1(PLK1)54)などへの結合も報告されている.詳細な機構は不明であるが,sorcinは細胞内Ca2+恒常性調節に関与し,sorcinの発現を抑制すると血管内皮増殖因子(VEGF)の発現を抑え,VEGF下流のシグナル応答が低下する52).sorcinはグルコース応答性転写因子ChREBPのN末端領域に結合し,細胞質に転写因子をとどめ,Ca2+濃度が上昇するとグルコースと結合したChREBPから離れることにより,核移行を制御している64).sorcinはin vitro結合解析でEDTA存在下,Ca2+存在下ともにALG-2との相互作用が報告され,ALG-2のN末端領域が結合部位と推定されているが65),その生理的意義は不明である.
3)grancalcin
grancalcinは1992年に報告され,好中球や単球で発現が高く,生理機能として白血球機能への関与が示唆された66).ノックアウトマウスは,目立った異常は認められなかったがエンドトキシンに対する生存率が少し上がり,好中球の付着率が低下した67, 68).grancalcinは白血球特異的アクチン結合タンパク質L-プラスチンとCa2+非存在下で結合し,Ca2+存在下で解離するが,その生理機能との関係は不明である69).N末端にsorcinより長いグリシンと疎水性残基に富む領域(NLT)を持つ.このNLT領域はToll様受容体9(TLR9)と相互作用し,形質細胞様樹状細胞においてNFκB経路を正に調節していると報告されている70).grancalcinはsorcinと最も近縁のPEFタンパク質であり,両者のヘテロ二量体形成も報告されている71).sorcinは脊椎動物に存在するがgrancalcinは哺乳類にしか見いだされていない.
1)ALIX
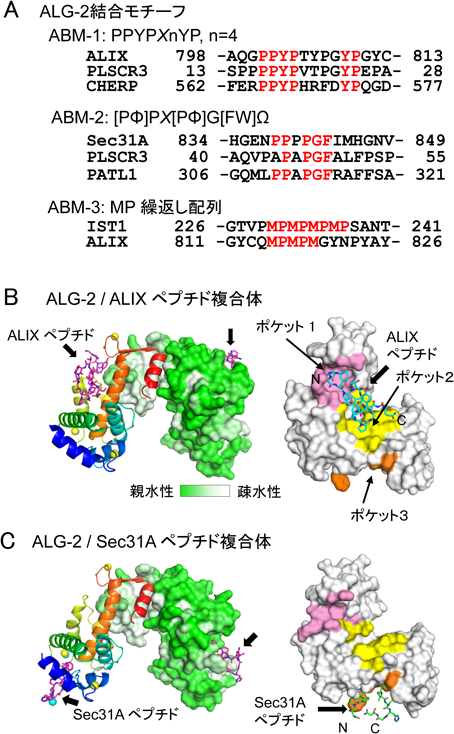
ALIX(ALG-2-interacting protein X,別名AIP1, PDCD6IP)は,ALG-2の相互作用因子として1999年に最初に報告され,ALIXへの結合が細胞死と関連づけられた75, 76).しかし,細胞死を誘導する詳細な分子機構は明らかとなっていない.ALIXのPRR中に存在する特徴的な配列(801-PPYPTYPGYPGY)がALG-2との結合に重要である77).このような配列はTubbyスーパーファミリーに属し,マウス3T3-L1細胞の脂肪細胞分化誘導を負に調節するPLSCR3(16-PPYPVTPGYPEP)78–80)や選択的スプライシング制御因子CHERP(565-PPYPHRFDYPQG)81)のALG-2結合部位にも存在し,ALG-2結合モチーフ1型(ABM-1)はコンセンサス配列PPYPXnP(X,任意アミノ酸残基,n=4)を持つ.
筆者らは,ALIXのALG-2結合領域合成ペプチドH-QGPPYPTYPGYPGYSQ-OHとALG-2との複合体のX線結晶構造解析を行い30),PPYPが疎水性ポケット1に,YPが疎水性ポケット2に入り込むことを示した(図4B).ポケット1の底面は二量体ALG-2分子中でそれぞれ対合している相手分子の残基Y180によって形成される.Y180はEF5に存在してALG-2ホモ二量体の対合形成に重要なクラスター残基の一つでもある9).したがってY180Aアミノ酸置換変異体は,二量体形成ができずポケット1が不完全となるためALIXとの結合能が失われる30, 82).ALG-2の立体構造をカルシウム結合型と非結合型とで比較すると,EF3に続くループ内のR125の側鎖がCa2+非存在下ではポケット1を塞ぎ,Ca2+存在下ではポケット1を開放するスイッチとして働くことが判明した30).哺乳類の動物細胞中には2残基(G121F122)が欠損したアイソフォーム(ΔGF122)がマイナー成分として存在するが83),このアイソフォームはALIXと結合できない78, 83).G121F122の欠損は,選択的スプライシングにより6塩基上流のドナー部位が使われるためである84).このアイソフォームはEF3に続くループ主鎖の欠損により,R125に相当するR123の側鎖がCa2+存在下でもポケット1を塞ぎ,また,ポケット1とポケット2の壁の変形がALIX結合能喪失の原因と考えられる85).
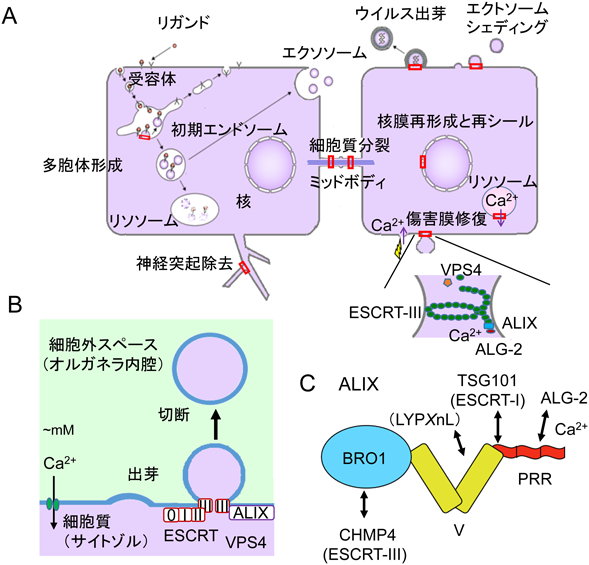
2)ESCRTシステム
上皮細胞増殖因子(EGF)受容体など膜タンパク質は,リガンドと結合するとエンドサイトーシスにより細胞内に取り込まれエンドソームに運ばれる.そして,積荷はユビキチン化されるとこれが目印となり,さらにリソソームへ運ばれて分解されるか,あるいはリサイクルされて細胞膜表面に戻されるかの選別が行われる86).積荷がエンドソームの内部小胞に送り込まれるとシグナル伝達が終結し,リソソーム分解経路に入る.このような内部小胞を持つエンドソームは,多胞体(multivesicular body:MVB)あるいは多胞性エンドソームと呼ばれている.MVB形成には多数の因子から構成された複合体であるエンドソーム選別輸送複合体(endosomal sorting complex required for transport:ESCRT)が働く87).ユビキチン結合能を持つESCRT-0複合体,ESCRT-I複合体とESCRT-II複合体が,受容体を取り込んだエンドソーム膜に順次集積する(図5).そして,ESCRT-III複合体構成因子(charged multivesicular body protein 4, CHMP4A, B, Cアイソフォームが存在)の重合により膜の変形を伴って内腔に出芽し,最後にAAA+型ATPaseであるVPS4の作用によりESCRTが解離し,膜の切断が起こる.ESCRTシステムはMVB選別輸送だけでなく,膜被覆ウイルスの細胞膜からの出芽,細胞外膜小胞の細胞膜からのシェディング,細胞質分裂における最終切断,核膜再形成,神経突起除去,損傷膜の修復などにおいても働き,幅広く細胞機能に関与している.使われるESCRTサブユニットや補助因子の種類は作動場所で異なる88–90).ABM-1コンセンサス配列とは完全には一致しないが,類似配列がアネキシンA11,アネキシンA7, TSG101, HD-PTP, VPS37B, VPS37C, MISSLなど,その他のALG-2相互作用因子にも見いだされている91–96).これらのタンパク質のうち,TSG101とVPS37B/CはESCRT-I複合体の構成因子であり,TSG101がユビキチン結合ドメインを持つ.ALIXとHD-PTPそしてBROX97)はともにBRO1ドメインを持ちCHMP4と結合する89, 94, 97–101).ALIXとHD-PTPはESCRTシステムにおける重要な補助因子として働いている88–90).
3)損傷膜修復におけるALG-2の役割
細胞膜が損傷を受けると,細胞外からのCa2+流入が引き金となって膜修復反応が起こるが,損傷の大小によって修復の仕組みは異なる102).レーザー照射によって細胞膜に小さな損傷を与えると,ALG-2, TSG101, ALIXを引き寄せてESCRTシステムを作動させ,損傷部位を切り取りながらシールするモデルが考えられている103).この場合,ALG-2は損傷膜に早期に集積するため,損傷センサーとして働いている.初発段階に作用する因子(ESCRT-0)は,必ずしもユビキチン化タンパク質認識因子である必要はなく,どのような状況でESCRTシステムが作動するかの使い分けがなされている90).このため,ALG-2もESCRT-0の一つと呼ぶことが提案されている103).ALG-2はCa2+依存的に膜に結合しやすい性質を持つため29),損傷部位に集積すると推察されるが,その詳細な分子機構は不明である.また電気穿孔(エレクトロポレーション)やジギトニン処理によって細胞膜に損傷を与えると,ALG-2遺伝子ノックアウトにより細胞の生存率が低下するが,逆にALG-2過剰発現によって生存率が高まる104).そしてALG-2結合ALIXペプチドを添加するとALG-2による保護作用が抑制される.これは内在性ALIXとの競合によると考えられ,損傷からの回復に対してALG-2やALIXが関与していると推察される.一般に,オルガネラは損傷するとオートファジーにより隔離され,リソソームと融合して分解除去される105).リソソーム膜自身が損傷を受けた場合にもオートファジーにより除去されるが(リソファジー),損傷が小さい場合,リソファジーが起こる前にESCRTシステムによって膜修復が行われる106, 107).この場合にもリソソーム内のCa2+漏出が損傷シグナルとなり,ALG-2がALIXやESCRTサブユニットとともに集積することが示されている106).
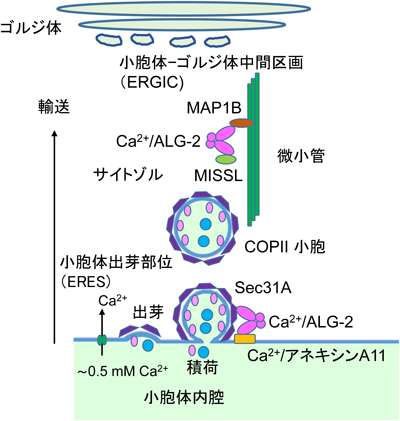
1)Sec31A
小胞体からゴルジ体への小胞による積荷輸送の過程は,多段階のメンブレントラフィック(膜交通)システムから成り立つ108).小胞体出芽部位(ER exit site:ERES)と称される特定部位で積荷が集積され,コートタンパク質複合体II型(coat protein complex II:COPII)小胞の出芽と離脱,そして小胞体-ゴルジ体中間区画(ERGIC)を経てゴルジ体への運搬が行われる(図6).低分子量GTPase Sar1の活性化が引き金となって,Sec23/Sec24複合体とSec13/Sec31A複合体が順次ERESに動員され,それぞれモル比1:1の多量体が籠状のCOPII小胞の内殻と外殻を形成する.ALG-2の細胞内分布を蛍光免疫染色法により顕微鏡観察すると,核近傍に細かい斑点状にみられ,Ca2+刺激により顕著になる.この斑点にはSec31Aや他のERESマーカーも共局在する109, 110).筆者らは,ALG-2がSec31Aに直接結合すること,そしてALIX型とは異なる新しいタイプのALG-2結合モチーフ(ABM-2)をSec31Aが持つことを明らかにした110, 111).PLSCR3にもABM-2配列が存在し78),ABM-2がポケット3に結合することをシミュレーション解析により前もって予測していたが112),Sec31AのALG-2結合部位の合成ペプチドH-NPPPPGFIMHGN-OHとALG-2との複合体のX線結晶構造解析により113),このことを直接的に証明した(図4C).この構造モデルによって,Sec31Aとは結合しないALG-2変異体F85AがALIXと結合すること,また,ALIXとは結合しないALG-2のアイソフォーム(ΔGF122)や変異体Y180Aに対してSec31Aが結合することが矛盾なく説明できる78, 113).筆者らはABM-2を従来PXPGFとしていたが84, 114),Sec31A結合部位の詳細な変異体解析により[PΦ]PX[PΦ]G[FW]Ω(Φ:疎水性アミノ酸残基,Ω:側鎖が大きなアミノ酸残基,X:任意アミノ酸残基)と新たに定義した113).ただし,Sec31Aペプチドは左巻きのII型ポリプロリンヘリックス(PPII helix)構造をとっており,Proの残基数が多いほど結合に有利と推察される.PLSCR3のABM-2類似配列(PAPAPGFALFPSP)のΩ位はアラニンであり,強い結合のためには,さらにC末端側の数残基の寄与が必要である.相互作用因子の結合によってALG-2二量体が安定化するが,二量体によって形成されるポケット1に結合するALIX(ABM-1)ペプチドのみならずABM-2ペプチドにもその効果が示されている33).
2)ALG-2による小胞体–ゴルジ体間小胞輸送調節
COPII形成に関わる因子群の組換え体と細胞抽出液を使って試験管内で出芽実験を行うと,ALG-2はCa2+依存的に出芽を抑制する115).また,リポソームを用いた結合実験により,ALG-2のSec31Aへの結合が内殻のSec23と外殻のSec31A/Sec13との結合を促進する.筆者らはALG-2をノックダウンすると,モデル積荷タンパク質である水疱性口内炎ウイルスVSV tsO45株のGFP融合糖タンパク質(tsO45-G-GFP)のゴルジ体への輸送が早まる結果を得ており116),ALG-2がERESからの出芽を遅らせることと矛盾しない.興味深いことにアネキシンA11のノックダウンでも同様の結果が得られた.Sec31AがCa2+/ALG-2を介してアネキシンA11と結合することから,小胞体膜上でアネキシンA11がCOPIIをとどめる働きがあると考えられる116).小胞体–ゴルジ体間の小胞輸送を行うCOPII小胞の大きさは通常60~80 nmであるが,コラーゲン前駆体やカイロミクロンなど巨大分子を内包するためにはCOPII小胞を300~400 nmに拡張する仕組みが必要となる117, 118).TANGO1はSH3ドメインを持ち,小胞体内腔でコラーゲンVIIと結合する積荷受容体である.そして,TANGO1および構造的に類似した細胞質ドメインを持つcTAGE5は複合体を形成し,それぞれのPRRがSec23/24と結合し,COPII小胞の増大化を行ってコラーゲン分泌を調節している119, 120).これら積荷受容体タンパク質のPRR中に繰り返し存在するProProPro配列がSec23と結合するため,二つのProProPro配列を持つSec31AがSec23に結合すると,Sec23/Sec24コートからTANGO1/cTAGE5を解離させSec31/Sec13が置き換わる121).Sec31Aに存在する二つのProProProのうち,一つはALG-2結合部位に含まれるが,前述したようにALG-2の存在はむしろSec31AとSec23の結合を強める115).ERESでのCOPII小胞サイズや輸送にはサブユニットやその相互作用因子群の翻訳後修飾による調節も報告されており,詳しくは別の総説を参照されたい118).
これまでに紹介したALG-2結合モチーフがプロリンを複数含みPRR中に存在することは,モチーフを構造的に柔軟な領域に位置づけることに寄与していると思われる.しかし,天然変性領域予測124)をすると,ABM-1, ABM-3の場合には必ずしも高い天然変性スコアを示すわけではない.ALG-2結合モチーフもしくは類似した配列を持っていても単独での結合は弱い.PATL1, CHERP, VPS37B, VPS37CやMISSLのように結合モチーフが分子内に複数存在することにより81, 95, 96, 114),あるいはTrk-fused gene(TFG)のように標的タンパク質がオリゴマー化することにより125),全体としてALG-2結合能を高めていると考えられる.また,PLSCR3のABM-2様配列のように周辺のアミノ酸残基によって結合が補強される場合もある113).さらに,ABM-3様の配列はALIXにも存在し(815-MPMPM, ABM-1のC末端側に位置)(図4A),ALIXとALG-2の結合親和性を高めていると思われる.
特定のPRRを持たずALG-2と相互作用する因子は,タンパク質リン酸化酵素などを含めいくつか報告されている(図3).しかし,詳細な結合部位が明らかにされているものは少なく,共通のモチーフとして類型化するには至っていない.以下,部位特異的アミノ酸置換変異体を用いて相互作用解析が行われ,結合部位もしくは重要残基が同定されている三つのケースについて紹介する.
1)TRPML1
TRPML1(transient receptor potential mucolipin 1,別名Mucolipin-1,遺伝子記号MCOLN1)は,後期エンドソーム,リソソームに局在する6回膜貫通型の陽イオンチャネルとして働き,オルガネラ内腔に貯留されたCa2+を細胞質ゾルに放出し,膜輸送調節にも関与する127).TRPML1の機能喪失変異は,神経疾患であるムコリピドーシスIV型のリソソーム蓄積症を引き起こし,オルガネラ内にはスフィンゴ脂質,ガングリオシド,糖タンパク質などが蓄積する128).TRPML1のN末端側66残基の細胞質ゾル領域がCa2+依存的にALG-2と結合するが,この領域に存在する酸性・塩基性・疎水性残基(ABH)クラスター(37-EEEDLRRRLKYFF)が結合に重要であり,44-RLK/AAAや47-YFF/AAA変異体はALG-2との結合が消失する129).蛍光タンパク質融合TRPML1を網膜色素上皮ARPE-19細胞に過剰に発現させ,後期エンドソーム・リソソームマーカーCD63(Lamp 3)との共局在率を調べると,ABHクラスターの変異体で低下する現象が観察され,ALG-2結合部位がTRPML1の細胞内局在に影響を与えることが示唆された.ALG-2の直接的影響については解析されていないが,TRPML1を介したリソソームからのCa2+放出がmTORC1のCa2+依存的活性化に関わっているとの報告があり130),リソソームを介したCa2+シグナルとALG-2との関係が注目される.
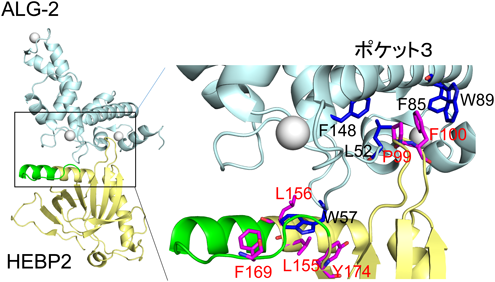
2)HEBP2
HEBP2(別名SOUL)は網膜で発現し,肝で発現しているヘム結合タンパク質HEBP1と相同性を持つ因子として発見されたものである131).マウスHEBP2は二量体であるが,ヘムと結合して六量体を形成するという報告がある132).しかし,ヒトHEBP2では実験的にヘムとの結合は再現できないため,ヘム結合タンパク質としての生理機能には疑問が残っている133).HEBP2の過剰発現はミトコンドリア膜透過性遷移孔(mitochondrial permeability transition pore:MPTP)を開き,過酸化水素刺激による細胞死を促進する報告があるが,これはHEBP2がBH3(Bcl-2-homology 3)ドメインを持ち,抗アポトーシス因子Bcl-xLと結合することによると考えられている134).BH3ドメインを含む合成ペプチド(HEBP2,アミノ酸残基番号147~172)とBcl-xLの複合体のX線結晶解析結果は,BH3ドメインペプチドがαヘリックスを形成して結合することを示し,また,NMRやSPR解析によっても相互作用が確認された133).しかし,HEBP2タンパク質全体とBcl-xLの結合は検出されなかった.HEBP2タンパク質中のBH3ドメインの一部はループを形成しており(図7),Bcl-xLとの結合のためには,疎水性相互作用部位である168-VFを含む部分がループからαヘリックスをとる大きな構造変化が必要となる.このため生理的条件下でのHEBP2とBcl-xLの相互作用は疑問視されている133).
最近,HEBP2とALG-2の相互作用について興味深い報告がなされた135).モデル細胞実験系において,ALG-2のノックダウンはHIV-1の複製を増幅し,逆に過剰発現は抑制した.HEBP2単独の過剰発現でもHIV-1の疑似粒子産生を抑制するが,ALG-2との共発現で抑制の相乗効果が観察された.ALIXやTSG101とは結合しないALG-2変異体ΔGF122の過剰発現ではむしろ強い抑制が起こるため,ESCRTシステムとは異なるメカニズムでHIV-1産生を抑制していると推測される.さらにHEBP2とALG-2との複合体のX線結晶構造解析が行われ135),HEBP2のF100はALG-2のポケット3に入り込み,HEBP2が持つBH3配列および前後に位置する残基から形成される疎水性パッチは,ポケット3の外壁に位置するW57と相互作用することが示された(図7).HEBP2自身はアポ型とALG-2結合型との間で大きな構造変化はなく,HEBP2とALG-2の結合様式は生理的条件下でも同じと考えられる.興味深いことにHEBP2二量体の結合によって,同じく二量体を形成しているALG-2各分子間の隙間の間隔が狭まる構造変化を誘導する.ALG-2・HEBP2複合体形成が他のALG-2相互作用因子との結合に対して,競合あるいは促進など対象分子ごとに異なる効果の可能性があり,今後の研究が待たれる.マウスHEBP2(SOUL)とマウスALG-2の組換え体を用い,ITCによるCa2+依存的な相互作用解析が行われた結果,Kd=32.4 nMと算出され,生理的にも細胞内で十分に複合体を形成すると推察される136).また,SOULのF100A変異体はALG-2との結合が喪失するが,ポケット3内部の疎水性残基を単独で変異させてもほとんど影響がなく,ポケット3内部においてもABM-2の結合様式とは異なると考えられる.
3)MAP1B
MISS(MAPK-interacting and spindle-stabilizing protein)は,MAPK基質タンパク質であり,マウス卵母細胞の減数分裂期においてERK2と相互作用し紡錘体を安定化する因子として発見された137).しかし,MISS遺伝子そのものはラットやヒトには存在しないのに対して,MISSと相同な遺伝子MISSL(遺伝子記号MAPK1IP1L)はマウスとともにラットやヒトにも存在する.ところがMAPK結合部位は欠如している.したがってMISS遺伝子の方がマウスで特異的にMAPK結合部位を獲得して進化したと考えられる.筆者らは,ALG-2相互作用タンパク質としてMISSLを同定したが,さらにMISSLと結合する因子を共免疫沈降産物の質量分析により探索し,微小管結合タンパク質MAP1Bを見いだした96).MISSLとMAP1Bの結合はCa2+キレート剤存在下では検出されず,また,Ca2+が存在してもALG-2ノックアウト細胞では検出されなかった.ALG-2二量体がCa2+存在下でMAP1BとMISSLにそれぞれ結合し,両者をつないでいると考えられる.マウスMAP1Bは2464アミノ酸残基からなる大きなタンパク質であるが,ALG-2結合部位を詳細に解析した結果,36残基(1813~1848)断片が結合に対して十分な領域であり,さらにアミノ酸置換変異体解析の結果,1825-PYGFR,特にF1828が重要であることが判明した138).ALG-2のポケット1,ポケット3の変異体あるいはΔGF122アイソフォーム(ポケット2構造変化)のいずれとも結合が喪失あるいは顕著に減弱した.したがって,ALG-2とMAP1Bの結合は,結晶構造上で結合様式が明らかにされているALIX, Sec31A, HEBP2とも様式が異なると思われる.
GFP-MISSLはCa2+依存的に一部ERESへの局在化が観察される.しかし蛍光免疫染色法による細胞内分布解析で,MAP1BとALG-2の共局在部位とSec31AとALG-2の共局在部位は分離して観察される96).恒常的に分泌型アルカリホスファターゼ(secretory alkaline phosphatase:SEAP)を発現するHeLa細胞を用いると,SEAPの分泌割合はMISSLあるいはALG-2のノックダウンにより低下するが,両者を同時にノックダウンしても分泌割合の加算的な低下は認められず,両者が複合体として同じ分泌経路で働いていることを示唆する96).そして,MISSLあるいはALG-2のノックダウン効果はMAP1Bのノックダウンによって消失する.この現象は微小管依存的小胞輸送をMAP1Bが抑制的に調節するが,そのためにはMISSL・ALG-2複合体のMAP1Bへの結合が関わっていると解釈される.ALG-2のノックダウンが積荷輸送に与える影響は,積荷分子間では異なって観察される.VSV-tsO45-G-GFP輸送では促進し116),SEAPとコラーゲン1前駆体輸送では抑制する96).ALG-2はCOPII小胞間の融合を阻害するが,Sec31AとALG-2との結合に必要なCa2+の供給源は小胞体に由来し,小胞体内のCa2+濃度を下げるとALG-2依存的COPII小胞間融合阻害が解除される139).また,VSV-tsO45-G-GFP輸送はpeflinのノックダウンで促進されるが,ALG-2との同時ノックダウンで促進が解除されるとの報告がある140).これは,ALG-2による輸送促進的機能をpeflinがALG-2を捕捉して無効にすると解釈されている.しかし,ALG-2およびpeflinの小胞体-ゴルジ体間小胞輸送調節の作用点は複数あり,ノックダウン実験でどの影響が大きく出やすいかは,積荷や細胞の種類,アッセイ方法など実験条件によって変わるため,解釈には注意を要する141).ALG-2に相互作用する未同定の調節因子が重要な働きをしている可能性がある.
引用文献References
1) Carafoli, E. & Krebs, J. (2016) Why Calcium? How calcium became the best communicator. J. Biol. Chem., 291, 20849–20857.
2) Rizzuto, R., Brini, M., Murgia, M., & Pozzan, T. (1993) Microdomains with high Ca2+ close to IP3-sensitive channels that are sensed by neighboring mitochondria. Science, 262, 744–747.
3) Berridge, M.J. (2006) Calcium microdomains: organization & function. Cell Calcium, 40, 405–412.
4) Berridge, M.J., Bootman, M.D., & Roderick, H.L. (2003) Calcium signalling: dynamics, homeostasis and remodelling. Nat. Rev. Mol. Cell Biol., 4, 517–529.
5) Yanez, M., Gil-Longo, J., & Campos-Toimil, M. (2012) Calcium binding proteins. Adv. Exp. Med. Biol., 740, 461–482.
6) Dominguez, D.C., Guragain, M., & Patrauchan, M. (2015) Calcium binding proteins and calcium signaling in prokaryotes. Cell Calcium, 57, 151–165.
7) Kretsinger, R.H. (1976) Calcium-binding proteins. Annu. Rev. Biochem., 45, 239–266.
8) Kawasaki, H. & Kretsinger, R.H. (2017) Structural and functional diversity of EF-hand proteins: Evolutionary perspectives. Protein Sci., 26, 1898–1920.
9) Denessiouk, K., Permyakov, S., Denesyuk, A., Permyakov, E., & Johnson, M.S. (2014) Two structural motifs within canonical EF-hand calcium-binding domains identify five different classes of calcium buffers and sensors. PLoS One, 9, e109287.
10) Ohno, S., Emori, Y., Imajoh, S., Kawasaki, H., Kisaragi, M., & Suzuki, K. (1984) Evolutionary origin of a calcium-dependent protease by fusion of genes for a thiol protease and a calcium-binding protein? Nature, 312, 566–570.
11) Sakihama, T., Kakidani, H., Zenita, K., Yumoto, N., Kikuchi, T., Sasaki, T., Kannagi, R., Nakanishi, S., Ohmori, M., & Takio, K. (1985) A putative Ca2+-binding protein: structure of the light subunit of porcine calpain elucidated by molecular cloning and protein sequence analysis. Proc. Natl. Acad. Sci. USA, 82, 6075–6079.
12) Blanchard, H., Grochulski, P., Li, Y., Arthur, J.S., Davies, P.L., Elce, J.S., & Cygler, M. (1997) Structure of a calpain Ca2+-binding domain reveals a novel EF-hand and Ca2+-induced conformational changes. Nat. Struct. Biol., 4, 532–538.
13) Lin, G.D., Chattopadhyay, D., Maki, M., Wang, K.K., Carson, M., Jin, L., Yuen, P.W., Takano, E., Hatanaka, M., DeLucas, L.J., et al. (1997) Crystal structure of calcium bound domain VI of calpain at 1.9 Å resolution and its role in enzyme assembly, regulation, and inhibitor binding. Nat. Struct. Biol., 4, 539–547.
14) Maki, M., Narayana, S.V., & Hitomi, K. (1997) A growing family of the Ca2+-binding proteins with five EF-hand motifs. Biochem. J., 328, 718–720.
15) Ono, Y. & Sorimachi, H. (2012) Calpains: an elaborate proteolytic system. Biochim. Biophys. Acta, 1824, 224–236.
16) Schad, E., Farkas, A., Jekely, G., Tompa, P., & Friedrich, P. (2002) A novel human small subunit of calpains. Biochem. J., 362, 383–388.
17) Maki, M., Kitaura, Y., Satoh, H., Ohkouchi, S., & Shibata, H. (2002) Structures, functions and molecular evolution of the penta-EF-hand Ca2+-binding proteins. Biochim. Biophys. Acta, 1600, 51–60.
18) Vito, P., Lacanà, E., & D’Adamio, L. (1996) Interfering with apoptosis: Ca2+-binding protein ALG-2 and Alzheimer’s disease gene ALG-3. Science, 271, 521–525.
19) Jang, I.K., Hu, R., Lacanà, E., D’Adamio, L., & Gu, H. (2002) Apoptosis-linked gene 2-deficient mice exhibit normal T-cell development and function. Mol. Cell. Biol., 22, 4094–4100.
20) Aviel-Ronen, S., Coe, B.P., Lau, S.K., da Cunha Santos, G., Zhu, C.Q., Strumpf, D., Jurisica, I., Lam, W.L., & Tsao, M.S. (2008) Genomic markers for malignant progression in pulmonary adenocarcinoma with bronchioloalveolar features. Proc. Natl. Acad. Sci. USA, 105, 10155–10160.
21) Yamada, Y., Arao, T., Gotoda, T., Taniguchi, H., Oda, I., Shirao, K., Shimada, Y., Hamaguchi, T., Kato, K., Hamano, T., et al. (2008) Identification of prognostic biomarkers in gastric cancer using endoscopic biopsy samples. Cancer Sci., 99, 2193–2199.
22) Zhang, L., Chen, X., Liu, B., & Han, J. (2018) MicroRNA-124-3p directly targets PDCD6 to inhibit metastasis in breast cancer. Oncol. Lett., 15, 984–990.
23) Hashemi, M., Bahari, G., Markowski, J., Malecki, A., Los, M.J., & Ghavami, S. (2018) Association of PDCD6 polymorphisms with the risk of cancer: Evidence from a meta-analysis. Oncotarget, 9, 24857–24868.
24) Ohkouchi, S., Nishio, K., Maeda, M., Hitomi, K., Adachi, H., & Maki, M. (2001) Identification and characterization of two penta-EF-hand Ca2+-binding proteins in Dictyostelium discoideum. J. Biochem., 130, 207–215.
25) Kitaura, Y., Matsumoto, S., Satoh, H., Hitomi, K., & Maki, M. (2001) Peflin and ALG-2, members of the penta-EF-hand protein family, form a heterodimer that dissociates in a Ca2+-dependent manner. J. Biol. Chem., 276, 14053–14058.
26) Teahan, C.G., Totty, N.F., & Segal, A.W. (1992) Isolation and characterization of grancalcin, a novel 28 kDa EF-hand calcium-binding protein from human neutrophils. Biochem. J., 286, 549–554.
27) Meyers, M.B., Zamparelli, C., Verzili, D., Dicker, A.P., Blanck, T.J., & Chiancone, E. (1995) Calcium-dependent translocation of sorcin to membranes: functional relevance in contractile tissue. FEBS Lett., 357, 230–234.
28) Mellgren, R.L. (1987) Calcium-dependent proteases: an enzyme system active at cellular membranes? FASEB J., 1, 110–115.
29) Maki, M., Yamaguchi, K., Kitaura, Y., Satoh, H., & Hitomi, K. (1998) Calcium-induced exposure of a hydrophobic surface of mouse ALG-2, which is a member of the penta-EF-hand protein family. J. Biochem., 124, 1170–1177.
30) Suzuki, H., Kawasaki, M., Inuzuka, T., Okumura, M., Kakiuchi, T., Shibata, H., Wakatsuki, S., & Maki, M. (2008) Structural basis for Ca2+ -dependent formation of ALG-2/Alix peptide complex: Ca2+/EF3-driven arginine switch mechanism. Structure, 16, 1562–1573.
31) Henzl, M.T., Frey, B.B., & Wolf, A.J. (2016) ALG-2 divalent-ion affinity: Calorimetric analysis of the des23 versions reveals high-affinity site for Mg2+. Biophys. Chem., 209, 28–40.
32) Tanner, J.J., Frey, B.B., Pemberton, T., & Henzl, M.T. (2016) EF5 is the high-affinity Mg2+ site in ALG-2. Biochemistry, 55, 5128–5141.
33) Henzl, M.T. (2018) Ligation events influence ALG-2 dimerization. Biophys. Chem., 239, 16–28.
34) Hoeflich, K.P. & Ikura, M. (2002) Calmodulin in action: diversity in target recognition and activation mechanisms. Cell, 108, 739–742.
35) Bahler, M. & Rhoads, A. (2002) Calmodulin signaling via the IQ motif. FEBS Lett., 513, 107–113.
36) Emori, Y., Kawasaki, H., Imajoh, S., Imahori, K., & Suzuki, K. (1987) Endogenous inhibitor for calcium-dependent cysteine protease contains four internal repeats that could be responsible for its multiple reactive sites. Proc. Natl. Acad. Sci. USA, 84, 3590–3594.
37) Takano, E., Maki, M., Mori, H., Hatanaka, M., Marti, T., Titani, K., Kannagi, R., Ooi, T., & Murachi, T. (1988) Pig heart calpastatin: identification of repetitive domain structures and anomalous behavior in polyacrylamide gel electrophoresis. Biochemistry, 27, 1964–1972.
38) Lee, W.J., Ma, H., Takano, E., Yang, H.Q., Hatanaka, M., & Maki, M. (1992) Molecular diversity in amino-terminal domains of human calpastatin by exon skipping. J. Biol. Chem., 267, 8437–8442.
39) Takano, J., Watanabe, M., Hitomi, K., & Maki, M. (2000) Four types of calpastatin isoforms with distinct amino-terminal sequences are specified by alternative first exons and differentially expressed in mouse tissues. J. Biochem., 128, 83–92.
40) Ma, H., Yang, H.Q., Takano, E., Lee, W.J., Hatanaka, M., & Maki, M. (1993) Requirement of different subdomains of calpastatin for calpain inhibition and for binding to calmodulin-like domains. J. Biochem., 113, 591–599.
41) Maki, M., Bagci, H., Hamaguchi, K., Ueda, M., Murachi, T., & Hatanaka, M. (1989) Inhibition of calpain by a synthetic oligopeptide corresponding to an exon of the human calpastatin gene. J. Biol. Chem., 264, 18866–18869.
42) Yang, H.Q., Ma, H., Takano, E., Hatanaka, M., & Maki, M. (1994) Analysis of calcium-dependent interaction between amino-terminal conserved region of calpastatin functional domain and calmodulin-like domain of mu-calpain large subunit. J. Biol. Chem., 269, 18977–18984.
43) Ma, H., Yang, H.Q., Takano, E., Hatanaka, M., & Maki, M. (1994) Amino-terminal conserved region in proteinase inhibitor domain of calpastatin potentiates its calpain inhibitory activity by interacting with calmodulin-like domain of the proteinase. J. Biol. Chem., 269, 24430–24436.
44) Takano, E., Ma, H., Yang, H.Q., Maki, M., & Hatanaka, M. (1995) Preference of calcium-dependent interactions between calmodulin-like domains of calpain and calpastatin subdomains. FEBS Lett., 362, 93–97.
45) Todd, B., Moore, D., Deivanayagam, C.C., Lin, G.D., Chattopadhyay, D., Maki, M., Wang, K.K., & Narayana, S.V. (2003) A structural model for the inhibition of calpain by calpastatin: crystal structures of the native domain VI of calpain and its complexes with calpastatin peptide and a small molecule inhibitor. J. Mol. Biol., 328, 131–146.
46) Moldoveanu, T., Gehring, K., & Green, D.R. (2008) Concerted multi-pronged attack by calpastatin to occlude the catalytic cleft of heterodimeric calpains. Nature, 456, 404–408.
47) Hanna, R.A., Campbell, R.L., & Davies, P.L. (2008) Calcium-bound structure of calpain and its mechanism of inhibition by calpastatin. Nature, 456, 409–412.
48) Rosenberger, G., Gal, A., & Kutsche, K. (2005) αPIX associates with calpain 4, the small subunit of calpain, and has a dual role in integrin-mediated cell spreading. J. Biol. Chem., 280, 6879–6889.
49) Pamonsinlapatham, P., Gril, B., Dufour, S., Hadj-Slimane, R., Gigoux, V., Pethe, S., L’Hoste, S., Camonis, J., Garbay, C., Raynaud, F., et al. (2008) Capns1, a new binding partner of RasGAP-SH3 domain in K-RasV12 oncogenic cells: modulation of cell survival and migration. Cell. Signal., 20, 2119–2126.
50) Beltran, L., Chaussade, C., Vanhaesebroeck, B., & Cutillas, P.R. (2011) Calpain interacts with class IA phosphoinositide 3-kinases regulating their stability and signaling activity. Proc. Natl. Acad. Sci. USA, 108, 16217–16222.
51) Van der Bliek, A.M., Meyers, M.B., Biedler, J.L., Hes, E., & Borst, P. (1986) A 22-kd protein (sorcin/V19) encoded by an amplified gene in multidrug-resistant cells is homologous to the calcium-binding light chain of calpain. EMBO J., 5, 3201–3208.
52) Gupta, K., Sirohi, V.K., Kumari, S., Shukla, V., Manohar, M., Popli, P., & Dwivedi, A. (2018) Sorcin is involved during embryo implantation via activating VEGF/PI3K/Akt pathway in mice. J. Mol. Endocrinol., 60, 119–132.
53) Genovese, I., Fiorillo, A., Ilari, A., Masciarelli, S., Fazi, F., & Colotti, G. (2017) Binding of doxorubicin to Sorcin impairs cell death and increases drug resistance in cancer cells. Cell Death Dis., 8, e2950.
54) Lalioti, V.S., Ilari, A., O’Connell, D.J., Poser, E., Sandoval, I.V., & Colotti, G. (2014) Sorcin links calcium signaling to vesicle trafficking, regulates Polo-like kinase 1 and is necessary for mitosis. PLoS One, 9, e85438.
55) Marmugi, A., Parnis, J., Chen, X., Carmichael, L., Hardy, J., Mannan, N., Marchetti, P., Piemonti, L., Bosco, D., Johnson, P., et al. (2016) Sorcin links pancreatic beta-cell lipotoxicity to ER Ca2+ stores. Diabetes, 65, 1009–1021.
56) Chen, X., Weber, C., Farrell, E.T., Alvarado, F.J., Zhao, Y.T., Gomez, A.M., & Valdivia, H.H. (2018) Sorcin ablation plus beta-adrenergic stimulation generate an arrhythmogenic substrate in mouse ventricular myocytes. J. Mol. Cell. Cardiol., 114, 199–210.
57) Gerke, V., Creutz, C.E., & Moss, S.E. (2005) Annexins: linking Ca2+ signalling to membrane dynamics. Nat. Rev. Mol. Cell Biol., 6, 449–461.
58) Brownawell, A.M. & Creutz, C.E. (1997) Calcium-dependent binding of sorcin to the N-terminal domain of synexin (annexin VII). J. Biol. Chem., 272, 22182–22190.
59) Zamparelli, C., Macquaide, N., Colotti, G., Verzili, D., Seidler, T., Smith, G.L., & Chiancone, E. (2010) Activation of the cardiac Na+–Ca2+ exchanger by sorcin via the interaction of the respective Ca2+-binding domains. J. Mol. Cell. Cardiol., 49, 132–141.
60) Zamparelli, C., Ilari, A., Verzili, D., Giangiacomo, L., Colotti, G., Pascarella, S., & Chiancone, E. (2000) Structure-function relationships in sorcin, a member of the penta EF-hand family. Interaction of sorcin fragments with the ryanodine receptor and an Escherichia coli model system. Biochemistry, 39, 658–666.
61) Matsumoto, T., Hisamatsu, Y., Ohkusa, T., Inoue, N., Sato, T., Suzuki, S., Ikeda, Y., & Matsuzaki, M. (2005) Sorcin interacts with sarcoplasmic reticulum Ca2+-ATPase and modulates excitation–contraction coupling in the heart. Basic Res. Cardiol., 100, 250–262.
62) Fowler, M.R., Colotti, G., Chiancone, E., Smith, G.L., & Fearon, I.M. (2008) Sorcin modulates cardiac L-type Ca2+ current by functional interaction with the α1C subunit in rabbits. Exp. Physiol., 93, 1233–1238.
63) Pack-Chung, E., Meyers, M.B., Pettingell, W.P., Moir, R.D., Brownawell, A.M., Cheng, I., Tanzi, R.E., & Kim, T.W. (2000) Presenilin 2 interacts with sorcin, a modulator of the ryanodine receptor. J. Biol. Chem., 275, 14440–14445.
64) Noordeen, N.A., Meur, G., Rutter, G.A., & Leclerc, I. (2012) Glucose-induced nuclear shuttling of ChREBP is mediated by sorcin and Ca2+ ions in pancreatic beta-cells. Diabetes, 61, 574–585.
65) Ilari, A., Fiorillo, A., Poser, E., Lalioti, V.S., Sundell, G.N., Ivarsson, Y., Genovese, I., & Colotti, G. (2015) Structural basis of Sorcin-mediated calcium-dependent signal transduction. Sci. Rep., 5, 16828.
66) Boyhan, A., Casimir, C.M., French, J.K., Teahan, C.G., & Segal, A.W. (1992) Molecular cloning and characterization of grancalcin, a novel EF-hand calcium-binding protein abundant in neutrophils and monocytes. J. Biol. Chem., 267, 2928–2933.
67) Roes, J., Choi, B.K., Power, D., Xu, P., & Segal, A.W. (2003) Granulocyte function in grancalcin-deficient mice. Mol. Cell. Biol., 23, 826–830.
68) Xu, P., Roes, J., Segal, A.W., & Radulovic, M. (2006) The role of grancalcin in adhesion of neutrophils. Cell. Immunol., 240, 116–121.
69) Lollike, K., Johnsen, A.H., Durussel, I., Borregaard, N., & Cox, J.A. (2001) Biochemical characterization of the penta-EF-hand protein grancalcin and identification of L-plastin as a binding partner. J. Biol. Chem., 276, 17762–17769.
70) Kim, T.W., Hong, S., Talukder, A.H., Pascual, V., & Liu, Y.J. (2016) Grancalcin (GCA) modulates Toll-like receptor 9 (TLR9) mediated signaling through its direct interaction with TLR9. Eur. J. Immunol., 46, 712–724.
71) Hansen, C., Tarabykina, S., la Cour, J.M., Lollike, K., & Berchtold, M.W. (2003) The PEF family proteins sorcin and grancalcin interact in vivo and in vitro. FEBS Lett., 545, 151–154.
72) Maki, M., Takahara, T., & Shibata, H. (2016) Multifaceted roles of ALG-2 in Ca2+-regulated membrane trafficking. Int. J. Mol. Sci., 17, E1401.
73) Ball, L.J., Kuhne, R., Schneider-Mergener, J., & Oschkinat, H. (2005) Recognition of proline-rich motifs by protein–protein-interaction domains. Angew. Chem. Int. Ed. Engl., 44, 2852–2869.
74) Ren, X. & Hurley, J.H. (2011) Proline-rich regions and motifs in trafficking: from ESCRT interaction to viral exploitation. Traffic, 12, 1282–1290.
75) Missotten, M., Nichols, A., Rieger, K., & Sadoul, R. (1999) Alix, a novel mouse protein undergoing calcium-dependent interaction with the apoptosis-linked-gene 2 (ALG-2) protein. Cell Death Differ., 6, 124–129.
76) Vito, P., Pellegrini, L., Guiet, C., & D’Adamio, L. (1999) Cloning of AIP1, a novel protein that associates with the apoptosis-linked gene ALG-2 in a Ca2+-dependent reaction. J. Biol. Chem., 274, 1533–1540.
77) Shibata, H., Yamada, K., Mizuno, T., Yorikawa, C., Takahashi, H., Satoh, H., Kitaura, Y., & Maki, M. (2004) The penta-EF-hand protein ALG-2 interacts with a region containing PxY repeats in Alix/AIP1, which is required for the subcellular punctate distribution of the amino-terminal truncation form of Alix/AIP1. J. Biochem., 135, 117–128.
78) Shibata, H., Suzuki, H., Kakiuchi, T., Inuzuka, T., Yoshida, H., Mizuno, T., & Maki, M. (2008) Identification of Alix-type and Non-Alix-type ALG-2-binding sites in human phospholipid scramblase 3: differential binding to an alternatively spliced isoform and amino acid-substituted mutants. J. Biol. Chem., 283, 9623–9632.
79) Inuzuka, T., Inokawa, A., Chen, C., Kizu, K., Narita, H., Shibata, H., & Maki, M. (2013) ALG-2-interacting Tubby-like protein superfamily member PLSCR3 is secreted by an exosomal pathway and taken up by recipient cultured cells. Biosci. Rep., 33, e00026.
80) Inokawa, A., Inuzuka, T., Takahara, T., Shibata, H., & Maki, M. (2015) Tubby-like protein superfamily member PLSCR3 functions as a negative regulator of adipogenesis in mouse 3T3-L1 preadipocytes by suppressing induction of late differentiation stage transcription factors. Biosci. Rep., 36, e00287.
81) Sasaki-Osugi, K., Imoto, C., Takahara, T., Shibata, H., & Maki, M. (2013) Nuclear ALG-2 protein interacts with Ca2+ homeostasis endoplasmic reticulum protein (CHERP) Ca2+-dependently and participates in regulation of alternative splicing of inositol trisphosphate receptor type 1 (IP3R1) pre-mRNA. J. Biol. Chem., 288, 33361–33375.
82) Okumura, M., Ichioka, F., Kobayashi, R., Suzuki, H., Yoshida, H., Shibata, H., & Maki, M. (2009) Penta-EF-hand protein ALG-2 functions as a Ca2+-dependent adaptor that bridges Alix and TSG101. Biochem. Biophys. Res. Commun., 386, 237–241.
83) Tarabykina, S., Moller, A.L., Durussel, I., Cox, J., & Berchtold, M.W. (2000) Two forms of the apoptosis-linked protein ALG-2 with different Ca2+ affinities and target recognition. J. Biol. Chem., 275, 10514–10518.
84) Maki, M., Suzuki, H., & Shibata, H. (2011) Structure and function of ALG-2, a penta-EF-hand calcium-dependent adaptor protein. Sci. China Life Sci., 54, 770–779.
85) Inuzuka, T., Suzuki, H., Kawasaki, M., Shibata, H., Wakatsuki, S., & Maki, M. (2010) Molecular basis for defect in Alix-binding by alternatively spliced isoform of ALG-2 (ALG-2ΔGF122) and structural roles of F122 in target recognition. BMC Struct. Biol., 10, 25.
86) Haglund, K. & Dikic, I. (2012) The role of ubiquitylation in receptor endocytosis and endosomal sorting. J. Cell Sci., 125, 265–275.
87) 柴田秀樹,牧正敏(2016)エンドソームでの輸送選別に働くESCRT装置,メンブレントラフィック—膜・小胞による細胞内輸送ネットワーク(福田光則,吉森保編),pp. 80–97,化学同人.
88) Henne, W.M., Buchkovich, N.J., & Emr, S.D. (2011) The ESCRT pathway. Dev. Cell, 21, 77–91.
89) McCullough, J., Colf, L.A., & Sundquist, W.I. (2013) Membrane fission reactions of the mammalian ESCRT pathway. Annu. Rev. Biochem., 82, 663–692.
90) Campsteijn, C., Vietri, M., & Stenmark, H. (2016) Novel ESCRT functions in cell biology: spiraling out of control? Curr. Opin. Cell Biol., 41, 1–8.
91) Satoh, H., Shibata, H., Nakano, Y., Kitaura, Y., & Maki, M. (2002) ALG-2 interacts with the amino-terminal domain of annexin XI in a Ca2+-dependent manner. Biochem. Biophys. Res. Commun., 291, 1166–1172.
92) Satoh, H., Nakano, Y., Shibata, H., & Maki, M. (2002) The penta-EF-hand domain of ALG-2 interacts with amino-terminal domains of both annexin VII and annexin XI in a Ca2+-dependent manner. Biochim. Biophys. Acta, 1600, 61–67.
93) Katoh, K., Suzuki, H., Terasawa, Y., Mizuno, T., Yasuda, J., Shibata, H., & Maki, M. (2005) The penta-EF-hand protein ALG-2 interacts directly with the ESCRT-I component TSG101, and Ca2+-dependently co-localizes to aberrant endosomes with dominant-negative AAA ATPase SKD1/Vps4B. Biochem. J., 391, 677–685.
94) Ichioka, F., Takaya, E., Suzuki, H., Kajigaya, S., Buchman, V.L., Shibata, H., & Maki, M. (2007) HD-PTP and Alix share some membrane-traffic related proteins that interact with their Bro1 domains or proline-rich regions. Arch. Biochem. Biophys., 457, 142–149.
95) Okumura, M., Katsuyama, A.M., Shibata, H., & Maki, M. (2013) VPS37 isoforms differentially modulate the ternary complex formation of ALIX, ALG-2, and ESCRT-I. Biosci. Biotechnol. Biochem., 77, 1715–1721.
96) Takahara, T., Inoue, K., Arai, Y., Kuwata, K., Shibata, H., & Maki, M. (2017) The calcium-binding protein ALG-2 regulates protein secretion and trafficking via interactions with MISSL and MAP1B proteins. J. Biol. Chem., 292, 17057–17072.
97) Ichioka, F., Kobayashi, R., Katoh, K., Shibata, H., & Maki, M. (2008) Brox, a novel farnesylated Bro1 domain-containing protein that associates with charged multivesicular body protein 4 (CHMP4). FEBS J., 275, 682–692.
98) Katoh, K., Shibata, H., Suzuki, H., Nara, A., Ishidoh, K., Kominami, E., Yoshimori, T., & Maki, M. (2003) The ALG-2-interacting protein Alix associates with CHMP4b, a human homologue of yeast Snf7 that is involved in multivesicular body sorting. J. Biol. Chem., 278, 39104–39113.
99) Katoh, K., Shibata, H., Hatta, K., & Maki, M. (2004) CHMP4b is a major binding partner of the ALG-2-interacting protein Alix among the three CHMP4 isoforms. Arch. Biochem. Biophys., 421, 159–165.
100) Strack, B., Calistri, A., Craig, S., Popova, E., & Göttlinger, H.G. (2003) AIP1/ALIX is a binding partner for HIV-1 p6 and EIAV p9 functioning in virus budding. Cell, 114, 689–699.
101) von Schwedler, U.K., Stuchell, M., Müller, B., Ward, D.M., Chung, H.Y., Morita, E., Wang, H.E., Davis, T., He, G.P., Cimbora, D.M., et al. (2003) The protein network of HIV budding. Cell, 114, 701–713.
102) Andrews, N.W., Almeida, P.E., & Corrotte, M. (2014) Damage control: cellular mechanisms of plasma membrane repair. Trends Cell Biol., 24, 734–742.
103) Scheffer, L.L., Sreetama, S.C., Sharma, N., Medikayala, S., Brown, K.J., Defour, A., & Jaiswal, J.K. (2014) Mechanism of Ca2+-triggered ESCRT assembly and regulation of cell membrane repair. Nat. Commun., 5, 5646.
104) la Cour, J.M., Winding Gojkovic, P., Ambjorner, S.E.B., Bagge, J., Jensen, S.M., Panina, S., & Berchtold, M.W. (2018) ALG-2 participates in recovery of cells after plasma membrane damage by electroporation and digitonin treatment. PLoS One, 13, e0204520.
105) Anding, A.L. & Baehrecke, E.H. (2017) Cleaning House: Selective Autophagy of Organelles. Dev. Cell, 41, 10–22.
106) Skowyra, M.L., Schlesinger, P.H., Naismith, T.V., & Hanson, P.I. (2018) Triggered recruitment of ESCRT machinery promotes endolysosomal repair. Science, 360, eaar5078.
107) Radulovic, M., Schink, K.O., Wenzel, E.M., Nahse, V., Bongiovanni, A., Lafont, F., & Stenmark, H. (2018) ESCRT-mediated lysosome repair precedes lysophagy and promotes cell survival. EMBO J., 37, e99753.
108) Zanetti, G., Pahuja, K.B., Studer, S., Shim, S., & Schekman, R. (2011) COPII and the regulation of protein sorting in mammals. Nat. Cell Biol., 14, 20–28.
109) Yamasaki, A., Tani, K., Yamamoto, A., Kitamura, N., & Komada, M. (2006) The Ca2+-binding protein ALG-2 is recruited to endoplasmic reticulum exit sites by Sec31A and stabilizes the localization of Sec31A. Mol. Biol. Cell, 17, 4876–4887.
110) Shibata, H., Suzuki, H., Yoshida, H., & Maki, M. (2007) ALG-2 directly binds Sec31A and localizes at endoplasmic reticulum exit sites in a Ca2+-dependent manner. Biochem. Biophys. Res. Commun., 353, 756–763.
111) Shibata, H., Inuzuka, T., Yoshida, H., Sugiura, H., Wada, I., & Maki, M. (2010) The ALG-2 binding site in Sec31A influences the retention kinetics of Sec31A at the endoplasmic reticulum exit sites as revealed by live-cell time-lapse imaging. Biosci. Biotechnol. Biochem., 74, 1819–1826.
112) Takahashi, T., Suzuki, H., Inuzuka, T., Shibata, H., & Maki, M. (2012) Prediction of a new ligand-binding site for type 2 motif based on the crystal structure of ALG-2 by dry and wet approaches. Int. J. Mol. Sci., 13, 7532–7549.
113) Takahashi, T., Kojima, K., Zhang, W., Sasaki, K., Ito, M., Suzuki, H., Kawasaki, M., Wakatsuki, S., Takahara, T., Shibata, H., et al. (2015) Structural analysis of the complex between penta-EF-hand ALG-2 protein and Sec31A peptide reveals a novel target recognition mechanism of ALG-2. Int. J. Mol. Sci., 16, 3677–3699.
114) Osugi, K., Suzuki, H., Nomura, T., Ariumi, Y., Shibata, H., & Maki, M. (2012) Identification of the P-body component PATL1 as a novel ALG-2-interacting protein by in silico and far-Western screening of proline-rich proteins. J. Biochem., 151, 657–666.
115) la Cour, J.M., Schindler, A.J., Berchtold, M.W., & Schekman, R. (2013) ALG-2 attenuates COPII budding in vitro and stabilizes the Sec23/Sec31A complex. PLoS One, 8, e75309.
116) Shibata, H., Kanadome, T., Sugiura, H., Yokoyama, T., Yamamuro, M., Moss, S.E., & Maki, M. (2015) A new role for annexin A11 in the early secretory pathway via stabilizing Sec31A protein at the endoplasmic reticulum exit sites (ERES). J. Biol. Chem., 290, 4981–4993.
117) Malhotra, V. & Erlmann, P. (2015) The pathway of collagen secretion. Annu. Rev. Cell Dev. Biol., 31, 109–124.
118) Aridor, M. (2018) COPII gets in shape: Lessons derived from morphological aspects of early secretion. Traffic, 19, 823–839.
119) Saito, K., Chen, M., Bard, F., Chen, S., Zhou, H., Woodley, D., Polischuk, R., Schekman, R., & Malhotra, V. (2009) TANGO1 facilitates cargo loading at endoplasmic reticulum exit sites. Cell, 136, 891–902.
120) Saito, K., Yamashiro, K., Ichikawa, Y., Erlmann, P., Kontani, K., Malhotra, V., & Katada, T. (2011) cTAGE5 mediates collagen secretion through interaction with TANGO1 at endoplasmic reticulum exit sites. Mol. Biol. Cell, 22, 2301–2308.
121) Ma, W. & Goldberg, J. (2016) TANGO1/cTAGE5 receptor as a polyvalent template for assembly of large COPII coats. Proc. Natl. Acad. Sci. USA, 113, 10061–10066.
122) Bajorek, M., Schubert, H.L., McCullough, J., Langelier, C., Eckert, D.M., Stubblefield, W.M., Uter, N.T., Myszka, D.G., Hill, C.P., & Sundquist, W.I. (2009) Structural basis for ESCRT-III protein autoinhibition. Nat. Struct. Mol. Biol., 16, 754–762.
123) Okumura, M., Takahashi, T., Shibata, H., & Maki, M. (2013) Mammalian ESCRT-III-related protein IST1 has a distinctive met-pro repeat sequence that is essential for interaction with ALG-2 in the presence of Ca2+. Biosci. Biotechnol. Biochem., 77, 1049–1054.
124) Varadi, M., Vranken, W., Guharoy, M., & Tompa, P. (2015) Computational approaches for inferring the functions of intrinsically disordered proteins. Front. Mol. Biosci., 2, 45.
125) Kanadome, T., Shibata, H., Kuwata, K., Takahara, T., & Maki, M. (2017) The calcium-binding protein ALG-2 promotes endoplasmic reticulum exit site localization and polymerization of Trk-fused gene (TFG) protein. FEBS J., 284, 56–76.
126) Marnef, A., Weil, D., & Standart, N. (2012) RNA-related nuclear functions of human Pat1b, the P-body mRNA decay factor. Mol. Biol. Cell, 23, 213–224.
127) Di Paola, S., Scotto-Rosato, A., & Medina, D.L. (2018) TRPML1: The Ca2+ retaker of the lysosome. Cell Calcium, 69, 112–121.
128) Colletti, G.A. & Kiselyov, K. (2011) TRPML1. Adv. Exp. Med. Biol., 704, 209–219.
129) Vergarajauregui, S., Martina, J.A., & Puertollano, R. (2009) Identification of the penta-EF-hand protein ALG-2 as a Ca2+-dependent interactor of mucolipin-1. J. Biol. Chem., 284, 36357–36366.
130) Li, R.J., Xu, J., Fu, C., Zhang, J., Zheng, Y.G., Jia, H., & Liu, J.O. (2016) Regulation of mTORC1 by lysosomal calcium and calmodulin. eLife, 5, e19360.
131) Zylka, M.J. & Reppert, S.M. (1999) Discovery of a putative heme-binding protein family (SOUL/HBP) by two-tissue suppression subtractive hybridization and database searches. Brain Res. Mol. Brain Res., 74, 175–181.
132) Sato, E., Sagami, I., Uchida, T., Sato, A., Kitagawa, T., Igarashi, J., & Shimizu, T. (2004) SOUL in mouse eyes is a new hexameric heme-binding protein with characteristic optical absorption, resonance Raman spectral, and heme-binding properties. Biochemistry, 43, 14189–14198.
133) Ambrosi, E., Capaldi, S., Bovi, M., Saccomani, G., Perduca, M., & Monaco, H.L. (2011) Structural changes in the BH3 domain of SOUL protein upon interaction with the anti-apoptotic protein Bcl-xL. Biochem. J., 438, 291–301.
134) Szigeti, A., Hocsak, E., Rapolti, E., Racz, B., Boronkai, A., Pozsgai, E., Debreceni, B., Bognar, Z., Bellyei, S., Sumegi, B., et al. (2010) Facilitation of mitochondrial outer and inner membrane permeabilization and cell death in oxidative stress by a novel Bcl-2 homology 3 domain protein. J. Biol. Chem., 285, 2140–2151.
135) Ma, J., Zhang, X., Feng, Y., Zhang, H., Wang, X., Zheng, Y., Qiao, W., & Liu, X. (2016) Structural and functional study of apoptosis-linked Gene-2. Heme-binding protein 2 interactions in HIV-1 production. J. Biol. Chem., 291, 26670–26685.
136) Mikasa, T., Kugo, M., Nishimura, S., Taketani, S., Ishijima, S., & Sagami, I. (2018) Thermodynamic characterization of the Ca2+-dependent interaction between SOUL and ALG-2. Int. J. Mol. Sci., 19, 3802.
137) Lefebvre, C., Terret, M.E., Djiane, A., Rassinier, P., Maro, B., & Verlhac, M.H. (2002) Meiotic spindle stability depends on MAPK-interacting and spindle-stabilizing protein (MISS), a new MAPK substrate. J. Cell Biol., 157, 603–613.
138) Takahara, T., Arai, Y., Kono, Y., Shibata, H., & Maki, M. (2018) A microtubule-associated protein MAP1B binds to and regulates localization of a calcium-binding protein ALG-2. Biochem. Biophys. Res. Commun., 497, 492–498.
139) Bentley, M., Nycz, D.C., Joglekar, A., Fertschai, I., Malli, R., Graier, W.F., & Hay, J.C. (2010) Vesicular calcium regulates coat retention, fusogenicity, and size of pre-Golgi intermediates. Mol. Biol. Cell, 21, 1033–1046.
140) Rayl, M., Truitt, M., Held, A., Sargeant, J., Thorsen, K., & Hay, J.C. (2016) Penta-EF-hand protein peflin is a negative regulator of ER-To-Golgi transport. PLoS One, 11, e0157227.
141) Shibata, H. (2019) Adaptor functions of the Ca2+-binding protein ALG-2 in protein transport from the endoplasmic reticulum. Biosci. Biotechnol. Biochem., 83, 20–32
142) Kitaura, Y., Watanabe, M., Satoh, H., Kawai, T., Hitomi, K., & Maki, M. (1999) Peflin, a novel member of the five-EF-hand-protein family, is similar to the apoptosis-linked gene 2 (ALG-2) protein but possesses nonapeptide repeats in the N-terminal hydrophobic region. Biochem. Biophys. Res. Commun., 263, 68–75.
143) Kitaura, Y., Satoh, H., Takahashi, H., Shibata, H., & Maki, M. (2002) Both ALG-2 and peflin, penta-EF-hand (PEF) proteins, are stabilized by dimerization through their fifth EF-hand regions. Arch. Biochem. Biophys., 399, 12–18.
144) Wiemuth, D., van de Sandt, L., Herr, R., & Gründer, S. (2012) Transient receptor potential N (TRPN1) from Xenopus interacts with the penta-EF-hand protein peflin. FEBS Lett., 586, 4276–4281.
145) Jin, L., Pahuja, K.B., Wickliffe, K.E., Gorur, A., Baumgartel, C., Schekman, R., & Rape, M. (2012) Ubiquitin-dependent regulation of COPII coat size and function. Nature, 482, 495–500.
146) McGourty, C.A., Akopian, D., Walsh, C., Gorur, A., Werner, A., Schekman, R., Bautista, D., & Rape, M. (2016) Regulation of the CUL3 ubiquitin ligase by a calcium-dependent co-adaptor. Cell, 167, 525–538.
147) Maeda, T. (2012) The signaling mechanism of ambient pH sensing and adaptation in yeast and fungi. FEBS J., 279, 1407–1413.
148) Peñalva, M.A., Lucena-Agell, D., & Arst, H.N. Jr. (2014) Liaison alcaline: Pals entice non-endosomal ESCRTs to the plasma membrane for pH signaling. Curr. Opin. Microbiol., 22, 49–59.
149) Yorikawa, C., Takaya, E., Osako, Y., Tanaka, R., Terasawa, Y., Hamakubo, T., Mochizuki, Y., Iwanari, H., Kodama, T., Maeda, T., et al. (2008) Human calpain 7/PalBH associates with a subset of ESCRT-III-related proteins in its N-terminal region and partly localizes to endocytic membrane compartments. J. Biochem., 143, 731–745.
150) Osako, Y., Maemoto, Y., Tanaka, R., Suzuki, H., Shibata, H., & Maki, M. (2010) Autolytic activity of human calpain 7 is enhanced by ESCRT-III-related protein IST1 through MIT-MIM interaction. FEBS J., 277, 4412–4426.
151) Maemoto, Y., Kiso, S., Shibata, H., & Maki, M. (2013) Analysis of limited proteolytic activity of calpain-7 using non-physiological substrates in mammalian cells. FEBS J., 280, 2594–2607.
152) Maemoto, Y., Ono, Y., Kiso, S., Shibata, H., Takahara, T., Sorimachi, H., & Maki, M. (2014) Involvement of calpain-7 in epidermal growth factor receptor degradation via the endosomal sorting pathway. FEBS J., 281, 3642–3655.
153) Vincent, O., Rainbow, L., Tilburn, J., Arst, H.N. Jr., & Peñalva, M.A. (2003) YPXL/I is a protein interaction motif recognized by Aspergillus PalA and its human homologue, AIP1/Alix. Mol. Cell. Biol., 23, 1647–1655.
154) Baietti, M.F., Zhang, Z., Mortier, E., Melchior, A., Degeest, G., Geeraerts, A., Ivarsson, Y., Depoortere, F., Coomans, C., Vermeiren, E., et al. (2012) Syndecan-syntenin-ALIX regulates the biogenesis of exosomes. Nat. Cell Biol., 14, 677–685.
155) Dores, M.R., Chen, B., Lin, H., Soh, U.J., Paing, M.M., Montagne, W.A., Meerloo, T., & Trejo, J. (2012) ALIX binds a YPX3L motif of the GPCR PAR1 and mediates ubiquitin-independent ESCRT-III/MVB sorting. J. Cell Biol., 197, 407–419.
156) Dores, M.R., Grimsey, N.J., Mendez, F., & Trejo, J. (2016) ALIX regulates the ubiquitin-independent lysosomal sorting of the P2Y1 purinergic receptor via a YPX3L motif. PLoS One, 11, e0157587.
157) Maki, M., Maemoto, Y., Osako, Y., & Shibata, H. (2012) Evolutionary and physical linkage between calpains and penta-EF-hand Ca2+-binding proteins. FEBS J., 279, 1414–1421.