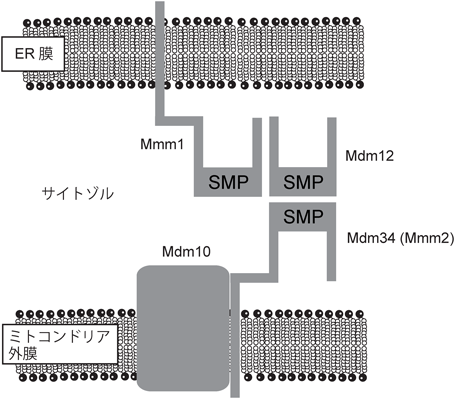
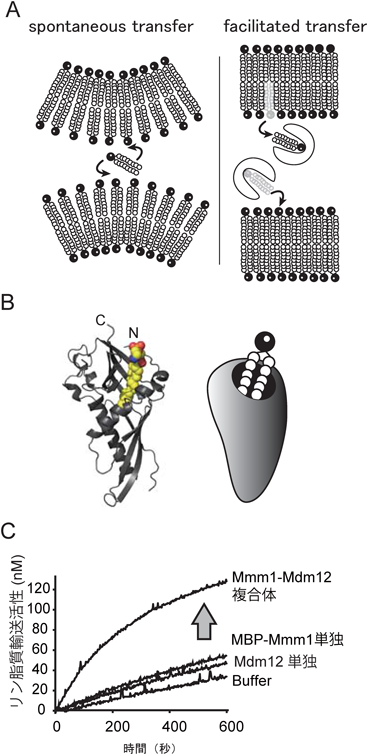
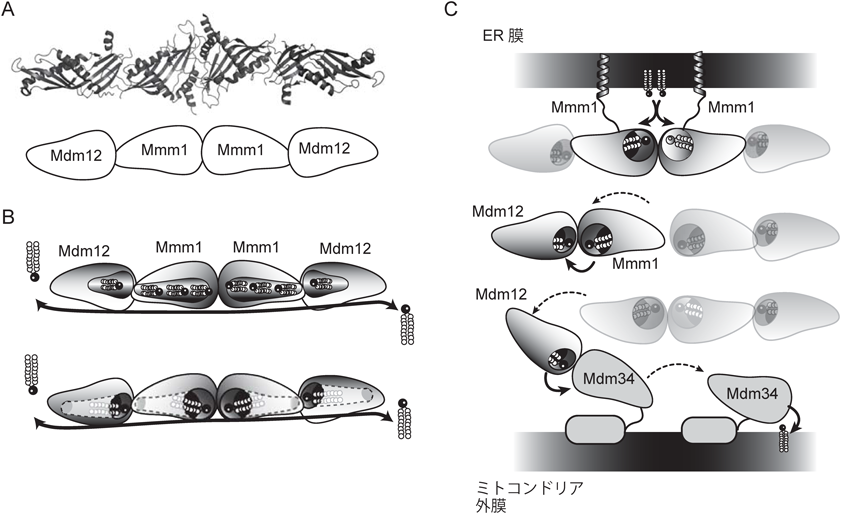
小胞体(ER)–ミトコンドリア間コンタクトサイトにおけるリン脂質輸送機構Mechanisms of phospholipid transfer at the contact sites between the ER and mitochondria
京都産業大学総合生命科学部Faculty of Life Sciences, Kyoto Sangyo University ◇ 〒603–8555 京都市北区上賀茂本山 ◇ Kamigamo-motoyama, Kita-ku, Kyoto 603–8555, Japan