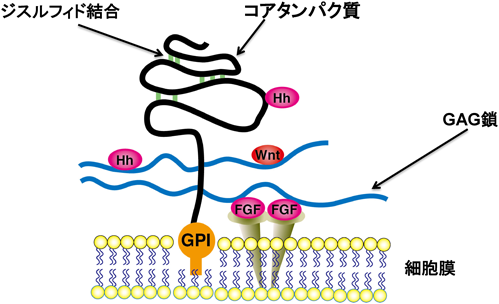
グリピカン(glypican:GPC)は,グリコシルホスファチジルイノシトールアンカー(glycosylphosphatidylinositol:GPI)を介して細胞膜に結合している膜結合型プロテオグリカンで,細胞表面上に直鎖状の硫酸化糖鎖であるグリコサミノグリカン(glycosaminoglycan:GAG)鎖を局在させることで,細胞外環境と細胞,あるいは細胞どうしの相互作用を制御する機能を持つ(図1).ヒトでは6種類のGPCが存在し,ヘッジホッグ(hedgehog:Hh)などの形態形成因子/細胞増殖因子と相互作用し,それらのシグナル伝達経路を制御する1).興味深いことに,これまでに,GPCはその種類により,Hhシグナル伝達経路の調節に関して,相反する機能を持つことが知られている.Hhシグナルは,哺乳類の初期発生において骨,神経,四肢などを含むさまざまな器官や臓器の形成に重要な役割を担っている.近年,常染色体劣性骨格異形成症の原因遺伝子としてGPC6が同定されたが,その機能や,病気の発症に関与する仕組みは不明であった.本稿では,著者らが明らかにしたGPC6のHhシグナル伝達制御機構を中心に紹介する.
GPCは,六つのメンバーからなるファミリー(GPC1~6)を形成している1).GPCファミリータンパク質の構造的な特徴として,約60~70 kDaの大きさで,高度に保存された14個のシステイン残基やGAG鎖であるヘパラン硫酸(heparan sulfate:HS)鎖やコンドロイチン硫酸鎖が結合するドメインを持つ.このドメインはC末端側にあり,GAG鎖をより細胞表面に近い位置に存在させることから,細胞外環境と細胞,あるいは細胞どうしの相互作用を制御する機能を持つと考えられている1).GPCには複数のGAG結合サイトがあり,それぞれGPC3には二つ,GPC5と6には四つ存在している.また,ほとんどのGPCはHS鎖が付加しているが,GPC5ではコンドロイチン硫酸鎖が付加していることが報告されている1).その他のドメインに関しては,他のタンパク質とは明らかな相同性がみられないことから,GPCは独自な機能を保持していることが示唆されている.
これまでにGPCは,形態形成因子/増殖因子であるHh,線維芽細胞増殖因子(fibroblast growth factor:FGF),ウィント(Wnt)や骨形成タンパク質(bone morphogenetic protein:BMP)と相互作用し,それらのシグナル伝達経路を制御することが明らかにされている1)(図1).つまりGPCは形態形成因子や細胞増殖因子とその受容体の相互作用を促進あるいは抑制することで,これらのシグナル伝達経路を制御している.
Hhは,哺乳類の初期発生において神経,四肢など骨格を含むさまざまな器官や臓器の形成に重要な役割を担う形態形成因子である2).これまでに,哺乳類では,ソニック・ヘッジホッグ(sonic hedgehog:Shh),デザート・ヘッジホッグ(desert hedgehog:Dhh)とインディアン・ヘッジホッグ(indian hedgehog:Ihh)の3種類が同定されている.Shhは多くの組織で産生されるが,DhhやIhnは限られた細胞でのみ産生される.特にIhhは,骨の形成時に発現している唯一のHhファミリーである3).Ihhは,軟骨細胞の増殖や分化を制御することにより,四肢や体幹の骨格形成において重要な機能を担うことが知られており,Ihhのノックアウト(knockout:KO)マウスは重篤な骨格形成異常の表現型を示す.
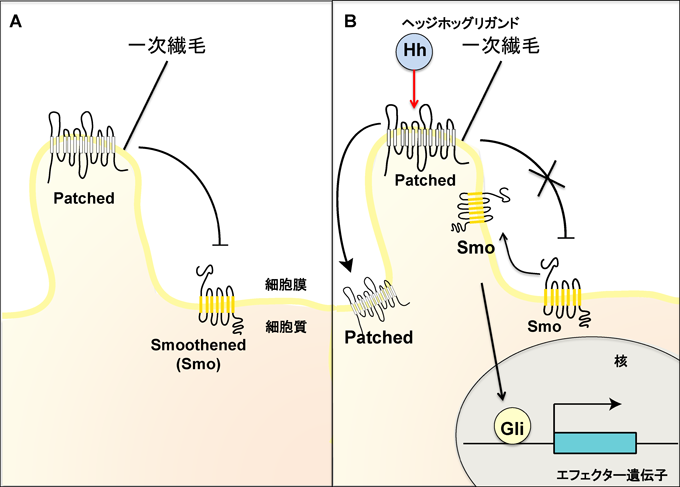
Hhの細胞内シグナルは,Hhの受容体であるパッチド(Patched)とスムースンド(Smoothened:Smo)によって仲介される.Patchedは,細胞膜の中でも特に一次繊毛(primary cilia)と呼ばれる細胞の突起部分に局在し,Hhと直接結合することにより活性化される4)(図2).Hhがない状態ではPatchedはSmoを阻害し,その下流の経路を抑制する(図2A).リガンドのHhが一次繊毛上のPatchedに結合すると,活性化Smoの一次繊毛への局在化が刺激され,Hh/Patched複合体が一次繊毛外へと移動し,入れ代わりにSmoが一次繊毛内へと進入する(図2B).このSmoの一次繊毛への局在化が刺激されることで転写因子であるGli[ショウジョウバエではCubitus interruptus(Ci)]に至るシグナル経路が活性化し,エフェクター遺伝子が転写される(図2B).Hhシグナルのターゲットとなる遺伝子は細胞特異的であるが,一般的には細胞周期(例:cyclinD1)や細胞の生存を制御する遺伝子(Bcl-2)で,フィードバックループによりHhシグナルに関与するPatchedおよびGliの発現も誘導する.Hhシグナル伝達経路が胚発生における組織形成に重要な機能を持つことからも,Hhシグナル伝達経路に関与する因子の異常は,全前脳症,短指症や骨形成異常症などの先天性の病気の原因となる.一次繊毛は,Hhシグナルの伝達に必須であることが明らかにされており,細胞膜上のセンサー的な役割を果たしている4, 5).
4. GPC3とGPC5によるHhシグナル伝達制御機構
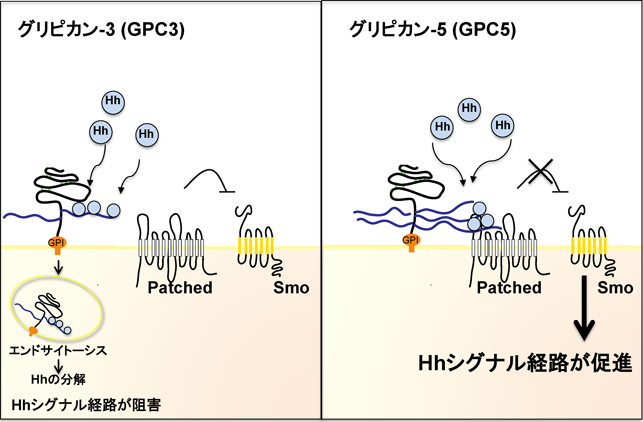
GPCによるHhシグナル伝達制御機構は,ショウジョウバエで初めて報告された6).哺乳類においては,GPCはHhシグナルの伝達に促進的あるいは抑制的に働くことが明らかにされている7).これまでに,GPC1とGPC5はHhシグナル伝達経路を促進させることが報告されている7, 8).一方,GPC3は,Hhシグナル伝達経路の抑制的に働くことが示されている9).著者の所属していた研究室のLiらは以前,GPC5が一次繊毛に局在し,Hhの受容体であるPatchedとHS鎖依存的に結合し,Hhシグナル伝達経路を促進させることを明らかにした.GPC5によるHhシグナル伝達経路の促進は,GPC5がリガンドであるHhおよび受容体のPatchedの両方に結合するためだと考えられる8)(図3).さらに,GPC5は小児や青年期における軟部肉腫の中で最も頻度の高い横紋筋肉腫(rhabdomyosarcoma:RMS)において,過剰発現していることが報告されている8).実際に,RMC患者由来の細胞において,GPC5がHhシグナル伝達経路を活性化することで,増殖を促進していることが示唆されている8).
一方,Capurroらは,GPC3がHhと高い親和性を持って結合し,一次繊毛には局在せず,Patchedとは結合しないことを明らかにした9).このGPC3とHhの結合により,エンドサイトーシスが誘導され,GPC3/Hh複合体は分解される.つまり,GPC3はPatchedとHhとの結合を阻害し,Hhシグナルの伝達に抑制的に働くと考えられている9)(図3).これまでに,GPC3の機能欠失型変異により,過成長症候群の一種であるシンプソン・ゴラビ・ベーメル(Simpson-Golabi-Behmel)症候群を発症することが報告されている10).
5. 常染色体劣性骨格異形成症の原因遺伝子GPC6のHhシグナル伝達経路への関与
常染色体劣性骨格異形成症(autosomal-reccessive omodysplasia:OMOD1)は,低身長,短縮四肢や顔異形によって特徴づけられる遺伝子疾患である11).さらに,患者において,睾丸停留,ヘルニア,先天性心疾患や発育遅延も報告されている.近年,OMOD1は,GPC6の機能欠失が原因であることが明らかにされた12).これまでにGPC6 KOマウスが作製され,胎生致死であることが明らかにされていた13).著者らも解析を行った結果,メンデル法則に従った割合で胎生17.5~18.5日のGPC6 KO胚は確認できたが,新生仔にはGPC6 KOマウスは確認できなかった.さらに,胎生17.5~18.5日胚を野生型やヘテロの同腹仔と比較すると,体重が有意に減少していった.そこで,胎生17.5日胚のアルシアンブルー/アリザリンレッド染色を行った結果,長管骨(大腿骨や上肢骨)が野生型と比較し有意に短かった1).さらに,骨端軟骨の軟骨細胞について,GPC6 KOマウスと野生型を比較した結果,KOマウスで増殖能が低下していた1).この結果は,GPC6が骨端軟骨板の増殖層において発現しているという報告と一致している14).さらに,GPC6 KOマウスでは重度の顔面異形成の表現型がみられた.これらの結果は,OMOD1の患者と非常に類似していた.また,注目すべきことに,GPC6 KOマウスの長管骨の短縮は,軟骨特異的Smo KOマウスの表現型と類似していた15).また,Ihh KOと同様に,大腿骨の組織切片染色により,骨端軟骨板の増殖層の層構造の異常がすべてのGPC6 KOマウスでみられた1).興味深いことに,OMOD1の患者においては,長骨の長さに関しては,GPC3の機能欠失型変異のシンプソン・ゴラビ・ベーメル症候群の患者と反対の表現型を示すことが報告されている.これらの結果より,OMOD1の患者において,GPC6のHhシグナルが減少していることが示唆された.
6. 一次繊毛でのGPC6のHhシグナル伝達機構の解明1)
GPC6が,Hhシグナルの伝達に関与しているかを調べるため,胎生15.5日胚の野生型およびGPC6 KOマウスの大腿骨を用いて,Hhシグナル伝達に重要なPatchedおよびGliの発現量をリアルタイムPCRで測定した.その結果,GPC6 KOマウスでは野生型と比較し,それらの発現量が有意に低下していた.これらの結果より,GPC6はHhシグナル伝達経路を促進する活性を保持している可能性が示唆された.
さらにGPC6/Ihhダブルヘテロマウスの胎生17.5日胚では,GPC6あるいはIhh単独のヘテロマウスより,体長が小さく,大腿骨が短い表現型を示した.また,GPC6 KO/Ihhヘテロマウスでは,GPC6 KO/Ihh野生型マウスよりも大腿骨が短い表現型を示した.GPC6/IhhダブルKOマウスとGPC6ヘテロ/Ihh KOマウスでは,GPC6野生型/Ihh KOマウスと同様の体重の減少および大腿骨が短くなる表現型が観察された.以上の結果より,GPC6による骨形成を促進する作用は,Ihhを介していることが強く示唆された.
次に,ルシフェラーゼレポーターアッセイを用いて,より詳細なGPC6によるHhシグナルの促進機構を解析した結果,GPC6は発現量依存的にHhシグナルを活性化した.さらに,pull-down法やBIACOREを用いた解析により,GPC6はPatchedと結合し,ShhおよびIhhと高親和性を保持することが明らかとなった.一方,HS鎖を欠損させたΔGPC6では,Patchedとの結合はほとんどみられず,ShhおよびIhhとの親和性も低下した.
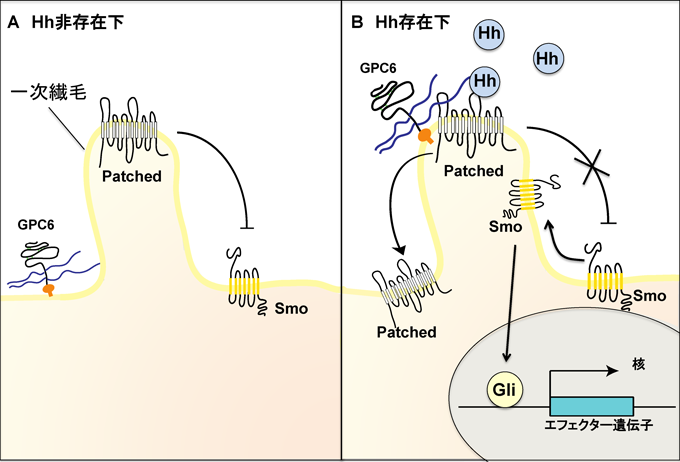
以前のGPC5の報告では,Hhシグナル伝達経路の活性化には,一次繊毛への局在が必要であることが示唆されていた.そこで,一次繊毛におけるGPC6の局在をマウス線維芽細胞および大腿骨由来の初代軟骨細胞を用いて調べた結果,これまでの報告とは異なり,GPC6は一次繊毛には局在しなかった(図4A).そこで,一次繊毛への局在化には,リガンドであるHhが必要だと予想し,Shhを添加後にGPC6の細胞膜上での局在を調べた結果,GPC6は一次繊毛へと局在が変化した(図4B).しかし,HS鎖を欠損させたΔGPC6では,Shhを添加しても一次繊毛への移動は観察されなかった.
また,GPC6を一過性に過剰発現させた細胞にShhを添加すると,コントロール細胞と比較し,Hh経路の調節を担う二つの受容体のうちPatchedはより早く一次繊毛から局在が消失し,一方,Smoはより早く一次繊毛へと局在することが明らかとなった.この両受容体の一次繊毛への局在の変化は,HS鎖を欠損させたΔGPC6を一過性に過剰発現させた細胞や野生型の細胞においてはみられなかった.また,Smoのアゴニストで処理し,Hhシグナルを活性化した細胞では,GPC6およびΔGPC6はShh添加時においても,一次繊毛には局在しなかった.これらの結果より,GPC6のGAG鎖とHhの結合が,GPC6の一次繊毛への局在化およびHhシグナルの活性化に重要であることが明らかとなった.さらに,GPCの一次繊毛への局在が,相反する機能を持つGPCによるHhシグナルの制御に関与していることが示唆された.
GPCは,GPIアンカーを介して,細胞膜に発現している非常にユニークなプロテオグリカンである.近年,すい臓がんの細胞外小胞(エクソソーム)に含まれるGPC1量が腫瘍マーカー(CA19-9)を上回る精度ですい臓がんと相関することが示され,早期発見が困難とされる膵臓がんの初期診断のマーカーになることが期待されている16).GPC1に関しても,GPC6と同様にHhシグナル伝達経路を促進することが報告されている1).また,GPC5は軟部肉腫のRMSにおいて,過剰発現していることが報告されている8).これらのことから,GPCを介したHhシグナルの異常が,がんをはじめさまざまな病気の発症に関与していることが示唆される.今回,GPC6がリガンドであるHhを添加後に一次繊毛へと局在し,Hh経路の調節を担う二つの受容体PatchedとSmoの局在を変化させることで,Hhシグナルの伝達を促進させることを明らかにした.しかし現在まで,Hh誘導的なGPC6の一次繊毛への移動機構は明らかとなっていない.今回,HS鎖を欠損させたΔGPC6では,Hh存在下においても一次繊毛への局在が見られなかったことより,GPC6の一次繊毛への移動は,GPC6のGAG鎖を介して誘導されると考えられる.今後は,GAG誘導的なGPC6の一次繊毛への移動機構を明らかにすることで,がんやOMOD1などのHhシグナルの異常による病気の原因の究明および新たな治療法の開発につながることが期待される.
謝辞Acknowledgments
本稿で紹介した研究は,Jorge Filmus研究室(トロント大学サニーブルック病院)行われた研究であり,Jorge Filmus教授,Mariana Capurro博士,金岩 知之博士,ラボマネージャーのWen Shi氏に深く感謝いたします.また,本研究に関わったすべての方に心より感謝申し上げます.
引用文献References
1) Capurro, M., Izumikawa, T., Suarez, P., Shi, W., Cydzik, M., Kaneiwa, T., Gariepy, J., Bonafe, L., & Filmus, J. (2017) Glypican-6 promotes the growth of developing long bones by stimulating Hedgehog signaling. J. Cell Biol., 216, 2911–2926.
2) Briscoe, J. & Therond, P.P. (2013) The mechanisms of Hedgehog signalling and its roles in development and disease. Nat. Rev. Mol. Cell Biol., 14, 418–431.
3) St-Jacques, B., Hammerschmidt, M., & McMahon, A.P. (1999) Indian hedgehog signaling regulates proliferation and differentiation of chondrocytes and is essential for bone formation. Genes Dev., 13, 2072–2086.
4) Rohatgi, R., Milenkovic, L., & Scott, M.P. (2007) Patched1 regulates hedgehog signaling at the primary cilium. Science, 317, 372–376.
5) Toftgard, R. (2009) Two sides to cilia in cancer. Nat. Med., 15, 994–996.
6) Lum, L., Yao, S., Mozer, B., Rovescalli, A., Von Kessler, D., Nirenberg, M., & Beachy, P.A. (2003) Identification of hedgehog pathway components by RNAi in Drosophila cultured cells. Science, 299, 2039–2045.
7) Filmus, J. & Capurro, M. (2014) The role of glypicans in Hedgehog signaling. Matrix Biol., 35, 248–252.
8) Li, F., Shi, W., Capurro, M., & Filmus, J. (2011) Glypican-5 stimulates rhabdomyosarcoma cell proliferation by activating Hedgehog signaling. J. Cell Biol., 192, 691–704.
9) Capurro, M.I., Xu, P., Shi, W., Li, F., Jia, A., & Filmus, J. (2008) Glypican-3 inhibits hedgehog signaling during development by competing with Patched for Hedgehog binding. Dev. Cell, 14, 700–711.
10) Pilia, G., Hughes-Benzie, R.M., MacKenzie, A., Baybayan, P., Chen, E.Y., Huber, R., Neri, G., Cao, A., Forabosco, A., & Schlessinger, D. (1996) Mutations in GPC3, a glypican gene, cause the Simpson-Golabi-Behmel overgrowth syndrome. Nat. Genet., 12, 241–247.
11) Elcioglu, N.H., Gustavson, K.H., Wlikie, A.O., Yuksel-Apak, M., & Spranger, J.W. (2004) Recessive omodysplasia:five new cases and review of the literature. Pediatr. Radiol., 34, 75–82.
12) Campos-Xavier, A.B., Martinet, D., Bateman, J., Belluocio, D., Rowley, L., Tan, T.Y., Baxova, A., Gustavson, K.H., Borochowitz, Z.U., Innes, A.M., et al. (2009) Mutations in the heparan-sulfate proteoglycan glypican-6 (GPC6) impair endochodral ossification and cause recessive omodysplasia. Am. J. Hum. Genet., 84, 760–770.
13) Tang, T., Li, L., Tang, J., Li, Y., Lin, W.Y., Martin, F., Grant, D., Solloway, M., Parker, L., Ye, W., et al. (2010) A mouse knockout library for secreted and transmembrane proteins. Nat. Biotechnol., 28, 749–755.
14) Ahrens, M.J., Li, Y., Jiang, H., & Dudley, A.T. (2009) Convergent extension movements in growth plate chondrocytes require gpi-anchored cell surface proteins. Development, 136, 3463–3474.
15) Long, F., Zhang, X.M., Karp, S., Yang, Y., & McMahon, A.P. (2001) Genetic manipulation of hedgehog signaling in the endochondral skeleton reveals a direct role in the regulation of chondrocyte proliferation. Development, 128, 5099–5108.
16) Melo, S.A., Luecke, L.B., Kahlert, C., Fernandez, A.F., Gammon, S.T., Kaye, J., LeBleu, V.S., Mittendorf, E.A., Weitz, J., Rahbari, N., et al. (2015) Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature, 523, 177–182.
著者紹介Author Profile
 泉川 友美(いずみかわ ともみ)
泉川 友美(いずみかわ ともみ)京都産業大学総合生命科学部研究助教.博士(薬学).
略歴2002年神戸薬科大学卒業.2007年同大学院修了.2007~2014年神戸薬科大学生化学研究室博士研究員.2014~2016年トロント大学サニーブルック病院 海外学振研究員.2016年より現職.
研究テーマと抱負グリコサミノグリカンの機能の解明を通じて,病気の原因究明や治療薬の開発に繋がる研究を目指しています.
ウェブサイトhttp://www.cc.kyoto-su.ac.jp/~itanon/index2.html
趣味カフェ&パン屋巡り,旅行.