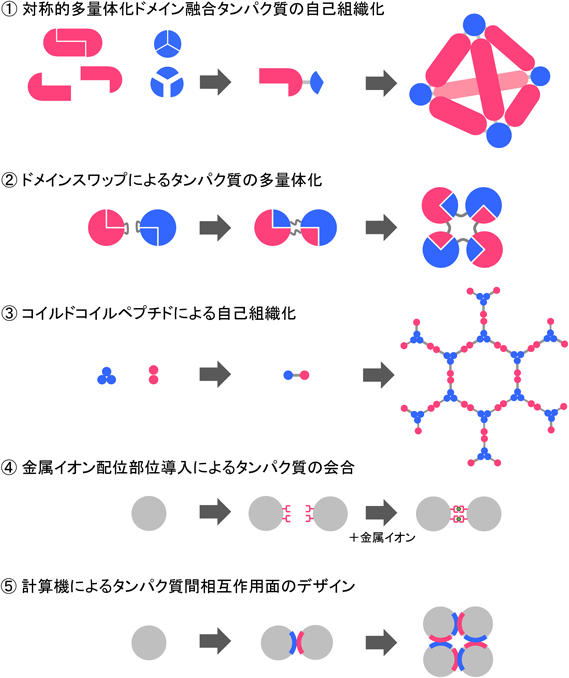
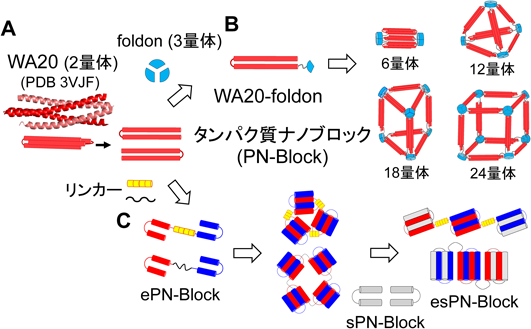
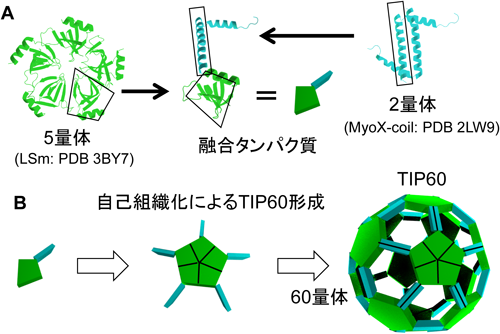
人工タンパク質ナノブロック複合体の設計開発Design of artificial protein complexes of protein nano-building blocks
1 信州大学繊維学部応用生物科学科Department of Applied Biology, Faculty of Textile Science and Technology, Shinshu University ◇ 〒386–8567 長野県上田市常田3–15–1 ◇ 3–15–1 Tokida, Ueda, Nagano 386–8567, Japan
2 自然科学研究機構生命創成探究センターProtein Design Group, Exploratory Research Center on Life and Living Systems, National Institutes of Natural Sciences ◇ 〒444–8585 愛知県岡崎市明大寺町西郷中38 ◇ 38 Nishigonaka, Myodaiji, Okazaki, Aichi 444–8585, Japan
3 慶應義塾大学理工学部生命情報学科Department of Bioscience and Informatics, Faculty of Science and, Technology, Keio University ◇ 〒223–8522 神奈川県横浜市港北日吉3–14–1 ◇ 3–14–1 Hiyoshi, Kohoku-Ku, Yokohama, Kanagawa 223–8522
4 信州大学菌類・微生物ダイナミズム創発研究センターDepartment of Supramolecular Complexes, Research Center for Fungal and Microbial Dynamism, Shinshu University ◇ 〒399–4598 長野県上伊那郡南箕輪村8304 ◇ 8304 Minamiminowa, Kamiina, Nagano 399–4598
5 信州大学先鋭領域融合研究群バイオメディカル研究所Institute for Biomedical Sciences, Interdisciplinary Cluster for Cutting Edge Research, Shinshu University ◇ 〒390–8621 長野県松本市旭3–1–1 ◇ 3–1–1 Asahi, Matsumoto, Nagano 390–8621