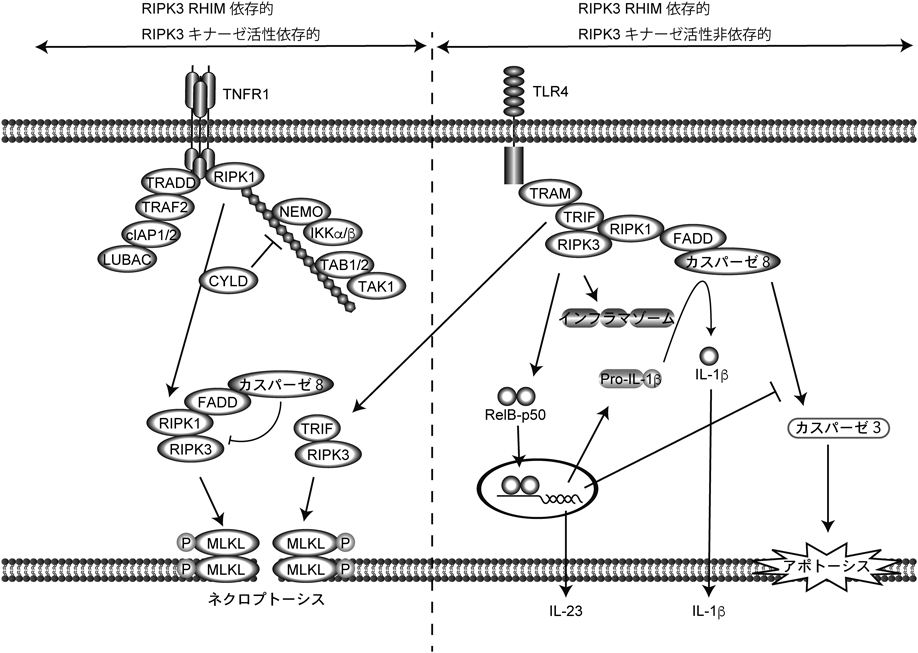
ネクロプトーシス誘導分子RIPK3による細胞死と炎症の制御RIPK3: The crucial kinase for cell death and inflammation
大阪大学大学院医学系研究科細胞生物学Department of Cell Biology, Osaka University Graduate School of Medicine ◇ 〒565–0871 大阪府吹田市山田丘2–2 バイオ棟5階 E51-07 ◇ E51-07, 2–2, Yamadaoka, Suita, Osaka 565–0871