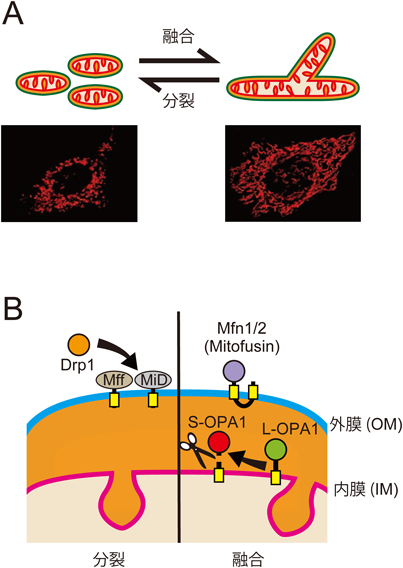
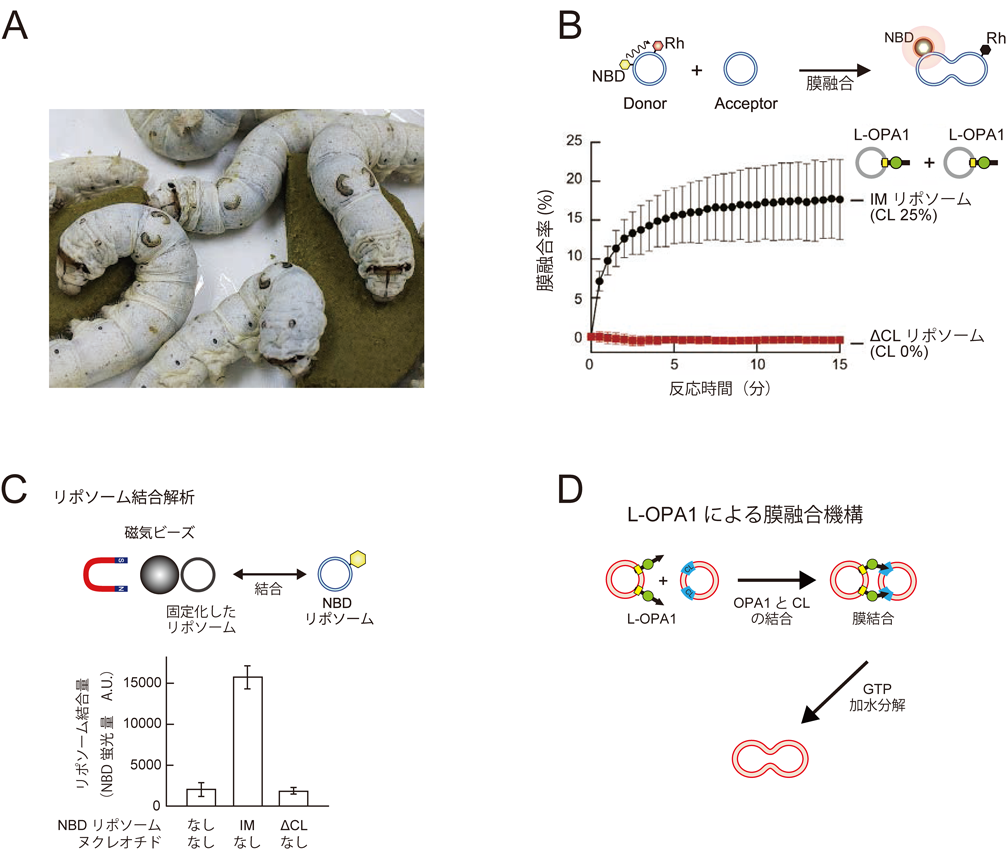
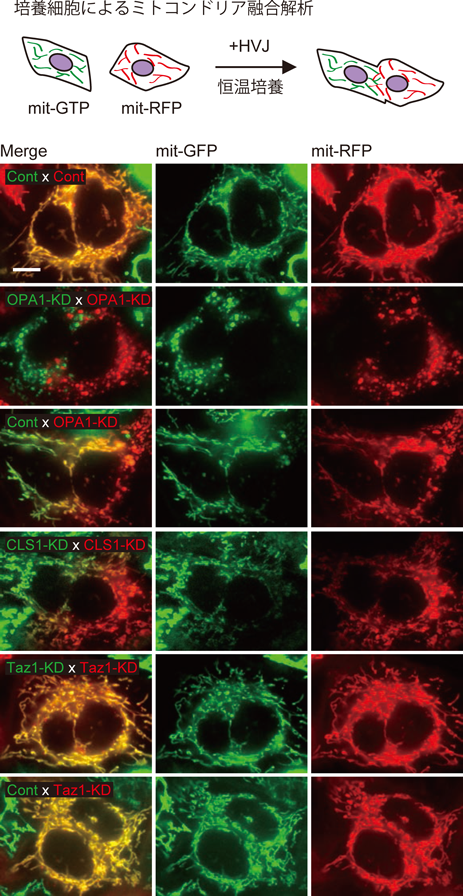
OPA1とカルジオリピンによるミトコンドリア内膜融合の制御Regulation of mitochondrial inner-membrane fusion by OPA1 and cardiolipin
1 大阪大学大学院理学研究科生物科学専攻Department of Biological Science, Graduate School of Science, Osaka University ◇ 〒560–0043 大阪府豊中市待兼山町1–1 ◇ 1–1 Machikaneyama-cho, Toyonaka, Osaka 560–0043, Japan
2 久留米大学分子生命科学研究所高分子化学研究部門Department of Protein Biochemistry, Institute of Life Science, Kurume University ◇ 〒830–0011 福岡県久留米市旭町67 ◇ 67 Asahi-machi, Kurume, Fukuoka 830–0011, Japan