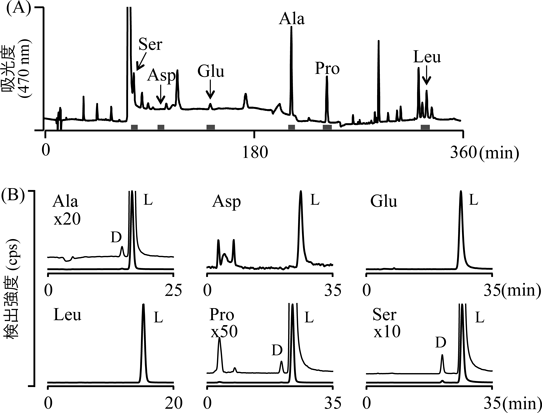
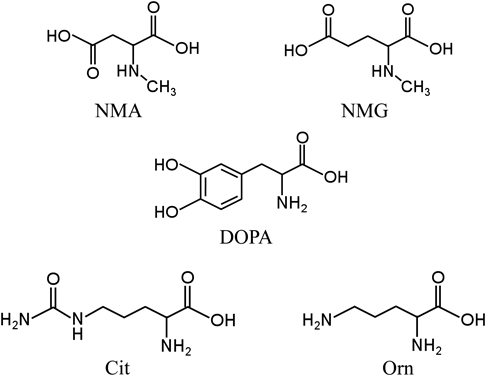
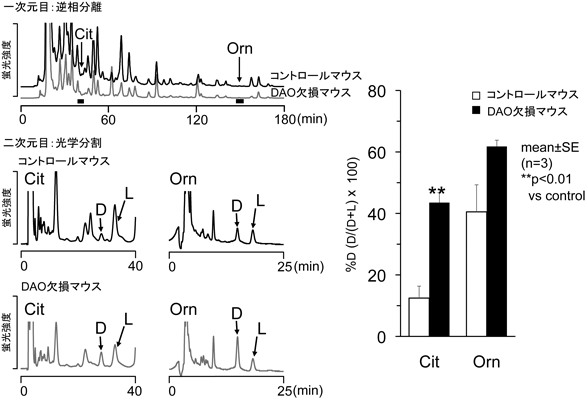
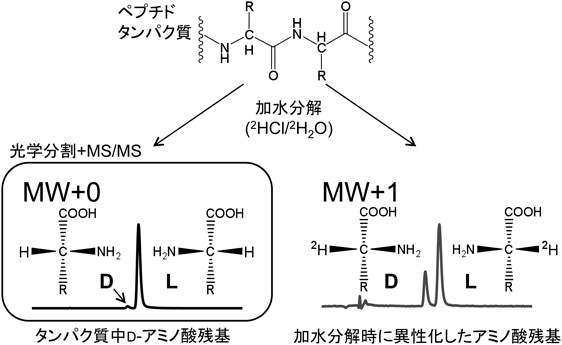
生体試料におけるD-アミノ酸微量分析技術Analysis of D-amino acids in biological matrices
1 九州大学大学院薬学研究院Graduate School of Pharmaceutical Sciences, Kyushu University ◇ 〒812–8582 福岡市東区馬出3–1–1 ◇ 3–1–1 Maidashi, Higashi-ku, Fukuoka 812–8582, Japan
2 福岡大学薬学部Faculty of Pharmaceutical Sciences, Fukuoka University ◇ 〒814–0180 福岡市城南区七隈8–19–1 ◇ 8–19–1 Nanakuma, Jonan-ku, Fukuoka 814–0180, Japan