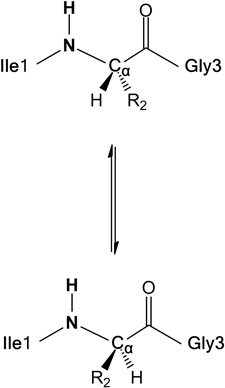
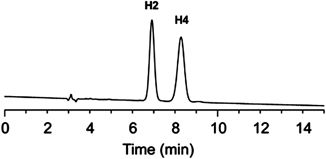
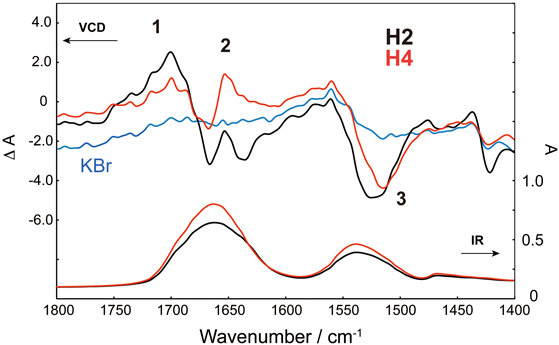
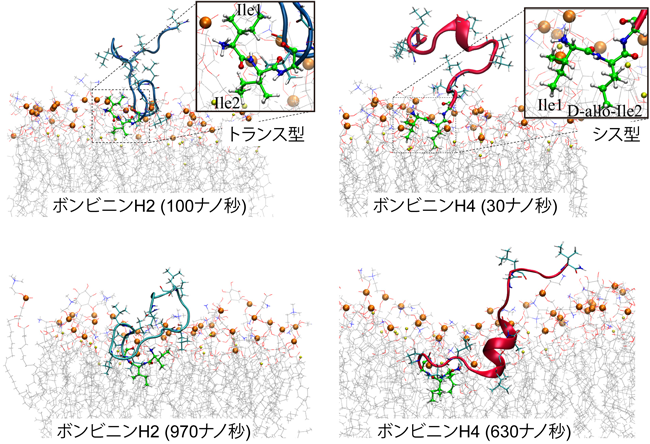
両生類由来抗菌ペプチドのD-アミノ酸の機能Function of D-amino acid containing antimicrobial peptide derived from frog
1 横浜国立大学大学院工学府機能発現工学専攻Grad. Sch. Eng., Yokohama Natl. Univ. ◇ 〒240–8501 神奈川県横浜市保土ヶ谷区常盤台79–5 ◇ 79–5 Tokiwadai, Hodogaya-ku, Yokohama-shi, Kanagawa 240–8501, Japan
2 横浜国立大学大学院理工学府化学・生命系理工学専攻Grad. Sch. Eng. Sci., Yokohama Natl. Univ. ◇ 〒240–8501 神奈川県横浜市保土ヶ谷区常盤台79–5 ◇ 79–5 Tokiwadai, Hodogaya-ku, Yokohama-shi, Kanagawa 240–8501, Japan
3 モンゴル国立大学応用工学科Sch. Eng. Applied Sci., Natl. Univ. Mongolia ◇ Ulaanbaatar, Mongolia ◇ Ulaanbaatar, Mongolia
4 愛媛大学大学院理工学研究科Grad. Sch. Sci. Eng., Ehime Univ. ◇ 〒790–8577 愛媛県松山市文京町2–5 ◇ 2–5 Bunkyo-cho, Matsuyama-shi, Ehime 790–8577, Japan