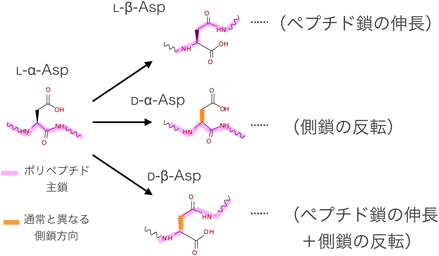
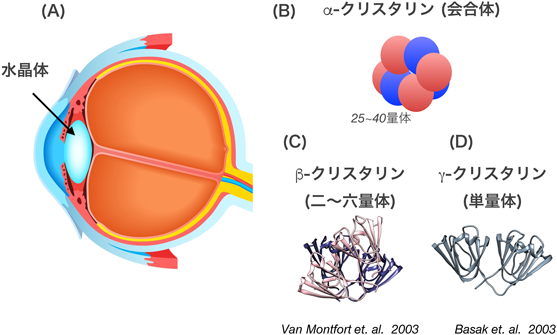
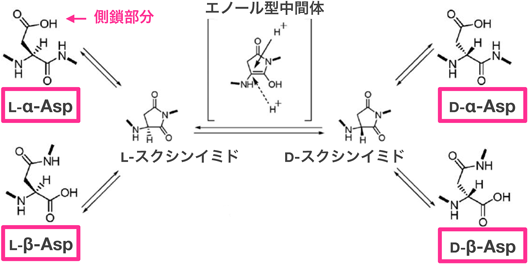
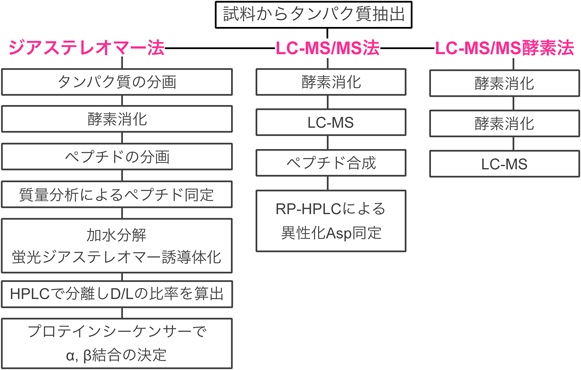
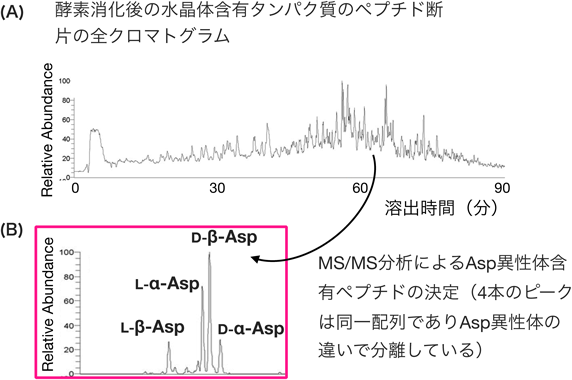
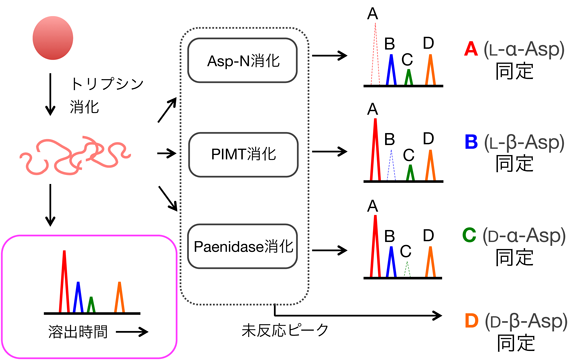
水晶体内クリスタリン中のアスパラギン酸残基の異性化The spontaneous isomerization of aspartate residues in lens crystallin
京都大学複合原子力科学研究所放射線生命科学研究部門基礎老化研究部門Kyoto University Institute for Integrated Radiation and Nuclear Science ◇ 〒590–0494 大阪府泉南郡熊取町朝代西2丁目 ◇ 2 Asashiro-nishi, Kumatori, Osaka 590–0494, Japan