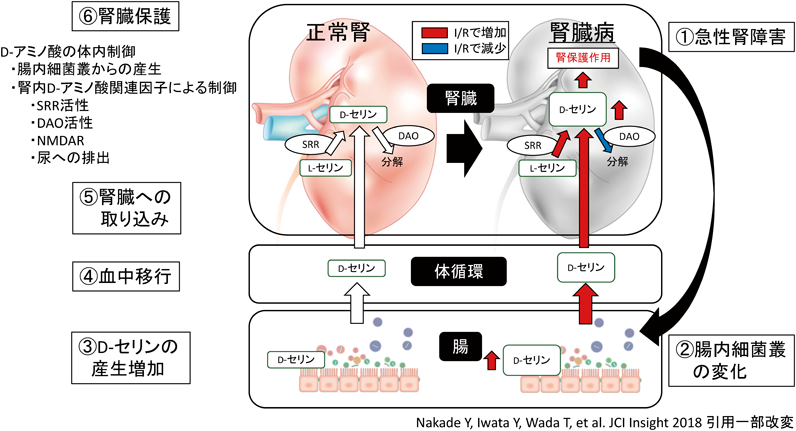
D-セリンと腎臓病The pathophysiologic role of D-serine in kidney disease
1 金沢大学附属病院検査部Clinical Laboratory, Kanazawa University Hospital ◇ 〒920–8641 石川県金沢市宝町13番1号 ◇ 13–1 Takara-machi, Kanazawa, Ishikawa 920–8641, Japan
2 金沢大学附属病院感染制御部Division of Infection Control, Kanazawa University Hospital ◇ 〒920–8641 石川県金沢市宝町13番1号 ◇ 13–1 Takara-machi, Kanazawa, Ishikawa 920–8641, Japan
3 金沢大学大学院腎病態統御学Department of Nephrology and Laboratory, Medicine, Kanazawa University ◇ 〒920–8641 石川県金沢市宝町13番1号 ◇ 13–1 Takara-machi, Kanazawa, Ishikawa 920–8641, Japan