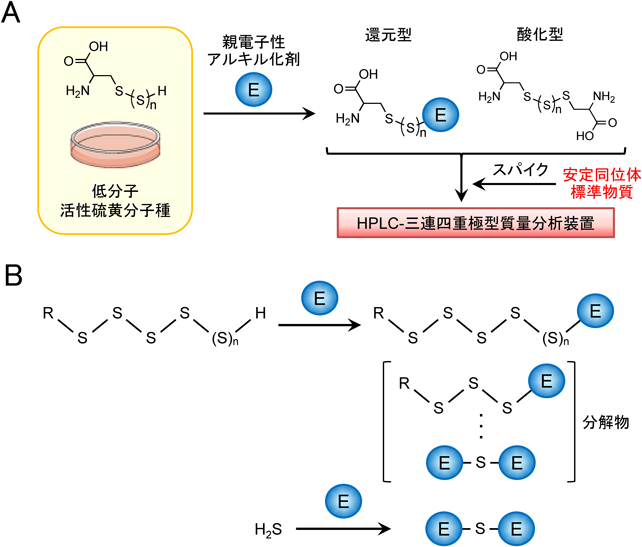
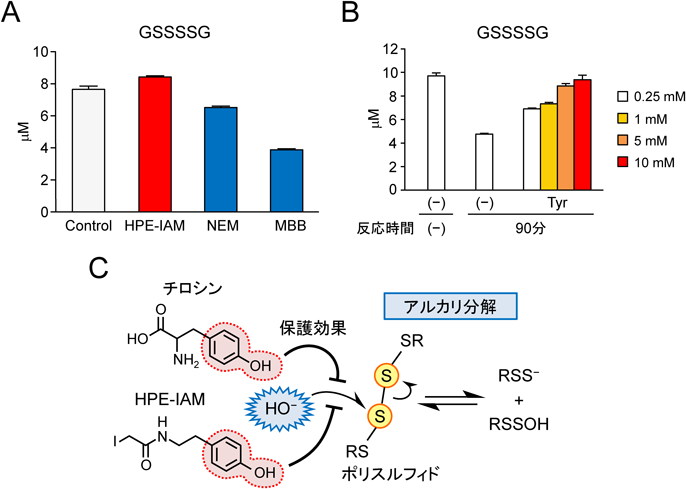
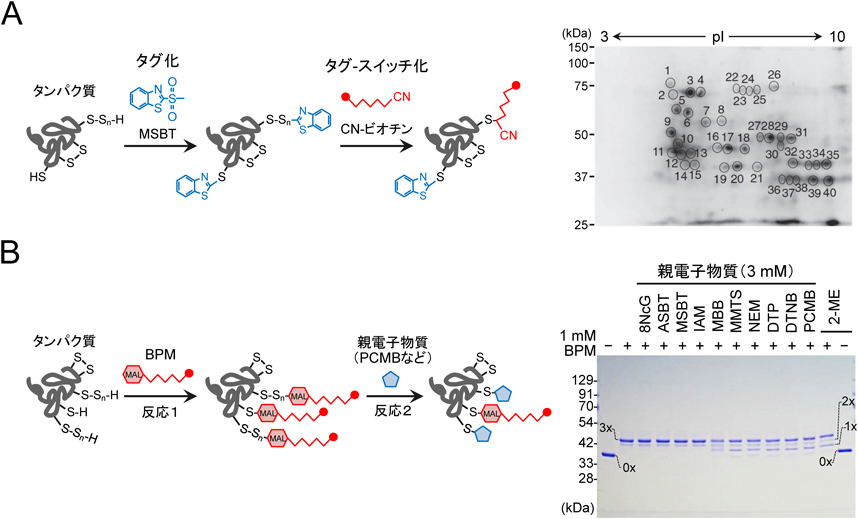
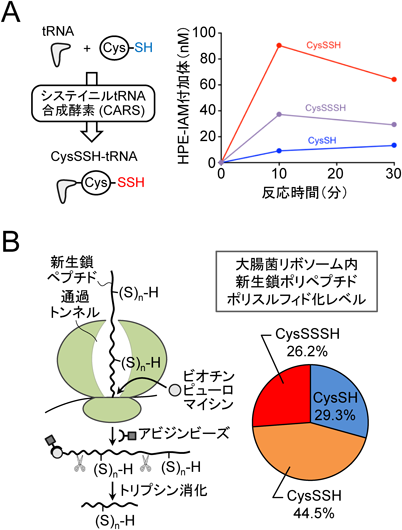
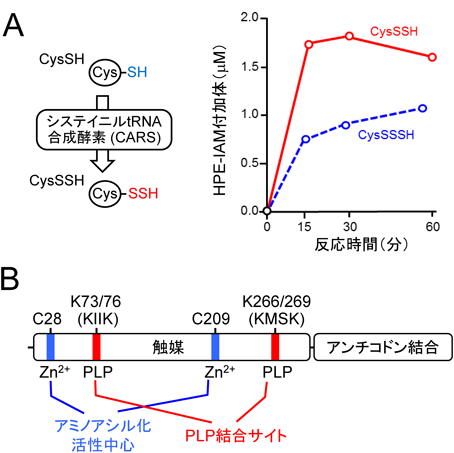
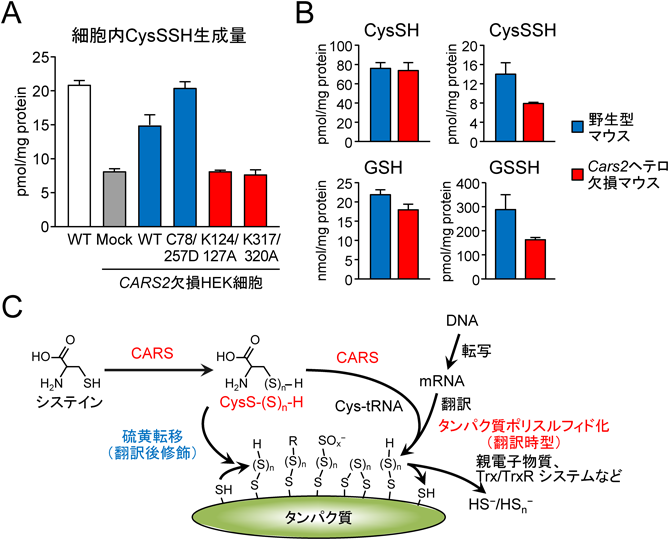
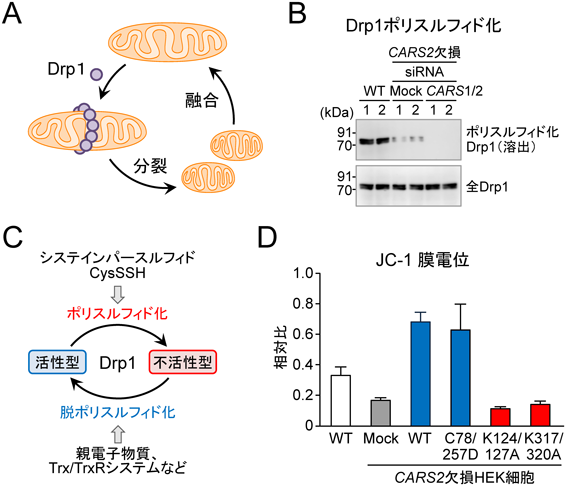
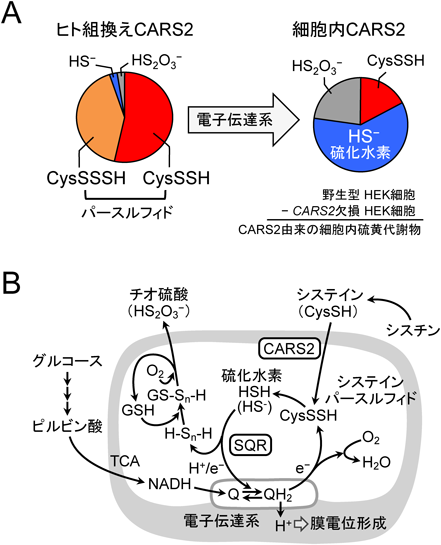
活性硫黄研究の新展開Recent advance in reactive sulfur research
1 大阪府立大学大学院理学系研究科生物科学専攻Department of Biological Science, Graduate School of Science, Osaka Prefecture University ◇ 〒599–8231 大阪府堺市中区学園町1–1 ◇ 1–1 Gakuen-cho, Nakaku, Sakai, Osaka 599–8231, Japan
2 東北大学加齢医学研究所遺伝子発現制御分野Department of Gene Expression Regulation, Institute of Development, Aging and Cancer, Tohoku University ◇ 〒980–8575 宮城県仙台市青葉区星陵町4–1 ◇ 4–1 Seiryocho, Aobaku, Sendai, Miyagi 980–8575, Japan
3 東北大学大学院医学系研究科環境医学分野Department of Environmental Health Science and Molecular Toxicology, Tohoku University Graduate School of Medicine ◇ 〒980–8575 宮城県仙台市青葉区星陵町2–1 ◇ 2–1 Seiryo-machi, Aoba-ku, Sendai, Miyagi 980–8575, Japan