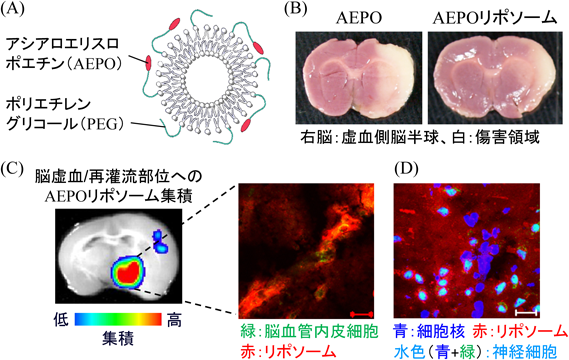
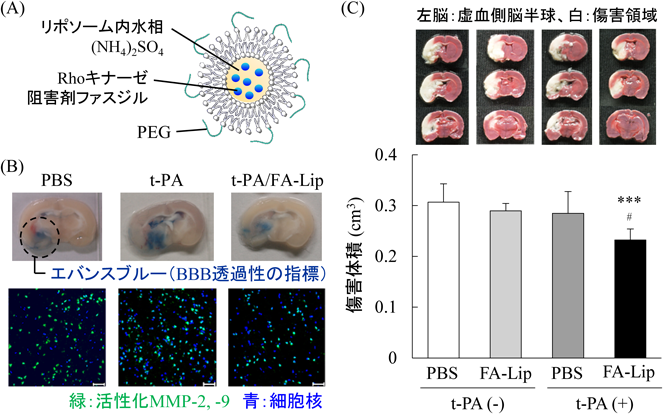
脂質微粒子リポソームを用いた脳梗塞治療法の開発Development of a new therapy for ischemic stroke by use of liposomal drug delivery system
1 徳島大学大学院医歯薬学研究部(薬学域)衛生薬学分野Department of Pharmaceutical Health Chemistry, Graduate School of Biomedical Sciences, Tokushima University ◇ 〒770–8505 徳島県徳島市庄町1丁目78–1 ◇ Shomachi 1, Tokushima 770–8505, Japan
2 静岡県立大学大学院薬学研究院医薬生命化学講座Department of Medical Biochemistry, School of Pharmaceutical Sciences, University of Shizuoka ◇ 〒422–8526 静岡県静岡市駿河区谷田52–1 ◇ 52–1 Yada, Suruga-ku, Shizuoka 422–8526
3 帝京大学薬学部Faculty of Pharma-Science, Teikyo University ◇ 〒173–8605 東京都板橋区加賀2–11–1 ◇ 2–11–1 Kaga, Itabashi-ku, Tokyo 173–8605, Japan