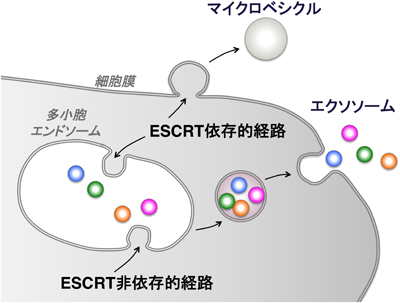
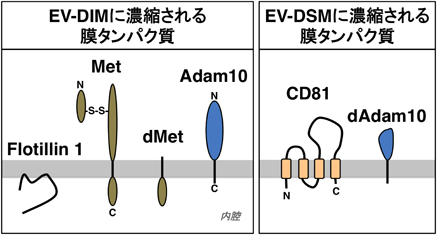
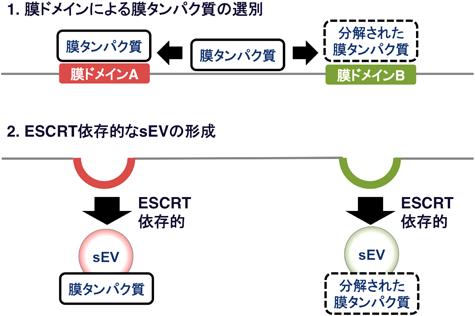
細胞外小胞の不均一性とその形成における膜ドメインの役割Roles of membrane domains in generating heterogeneity of extracellular vesicles
1 鹿児島大学大学院医歯学総合研究科システム血栓制御学講座Department of Systems Biology in Thromboregulation, Kagoshima University Graduate School of Medical and Dental Sciences ◇ 〒890–8544 鹿児島県鹿児島市桜ヶ丘8–35–1 ◇ 8–35–1 Sakuragaoka, Kagoshima 890–8544, Japan
2 大阪国際がんセンター研究所糖鎖オンコロジー部Department of Glyco-Oncology and Medical Biochemistry, Osaka International Cancer Institute ◇ 〒541–8567 大阪府大阪市中央区大手前3–1–69 ◇ 3–1–69 Otemae, Chuo-ku, Osaka 541–8567, Japan