食事に由来する脂質は,十二指腸で胆汁により乳化され,膵リパーゼの働きでモノアシルグリセロールと遊離脂肪酸に分解される.モノアシルグリセロールと遊離脂肪酸は,胆汁酸の働きによりミセルとなり小腸より吸収されるが,一部吸収しきれなかったものは大腸に達する.遊離脂肪酸の中でも,遊離不飽和脂肪酸は,多くの細菌に対し生育阻害を示す.腸内細菌に代表される嫌気性細菌は,この生育阻害を回避する解毒機構として,遊離不飽和脂肪酸をより毒性が低い遊離飽和脂肪酸へと変換することが知られていた.1960年代にその概要がButyrivibrio fibrisolvensにおいて解析され1),さまざまな生理活性が報告されている共役脂肪酸(分子内に共役した二重結合を有する脂肪酸)2)が代謝中間体となっていることが示されていたが代謝の詳細は不明であった3).我々は,腸内細菌の一種である乳酸菌を用いて腸内細菌に特異な不飽和脂肪酸代謝を探索し,興味深い代謝を複数見いだしている.
1)不飽和脂肪酸の飽和化
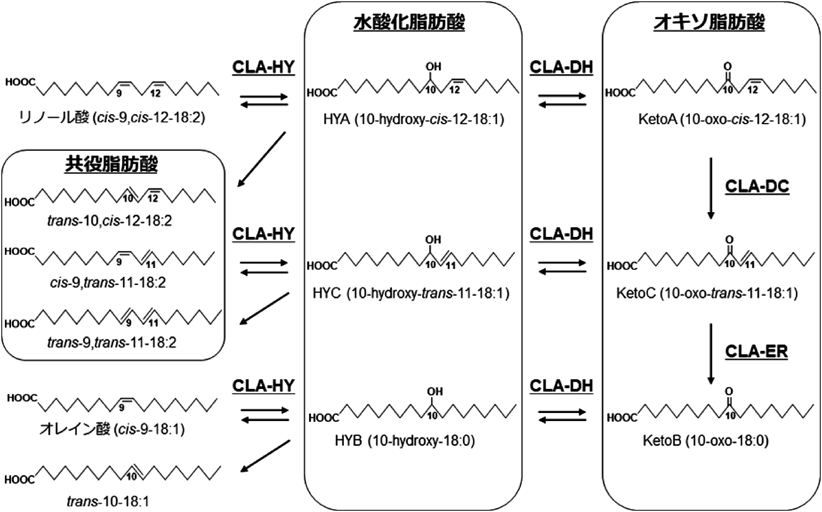
我々は,腸内細菌の一種であり,小腸での存在も報告されている乳酸菌Lactobacillus plantarumが食事脂質の主な構成脂肪酸であるリノール酸を共役化する際に水酸化脂肪酸を副生することを見いだしていた4).引き続く代謝解析の結果,不飽和結合への水和反応とそれに続く脱水を伴う二重結合の転位反応により,リノール酸が共役化されることを解明した5–7).この共役異性化反応を酵素レベルで解析する過程で,CLA-HY, CLA-DH, CLA-DC, CLA-ERと名づけた四つの酵素によりリノール酸が飽和化される特異な代謝を見いだした8–10).本代謝においては,リノール酸がオレイン酸[cis-9-octadecenoic acid(18 : 1)]ならびにtrans-10-18 : 1へと,C10水酸化体(10-hydroxy-cis-12-18 : 1, HYA),C10オキソ体(10-oxo-cis-12-18 : 1, KetoA),C10エノン体(10-oxo-trans-11-18 : 1, KetoC)といった特徴的な代謝中間体を経て飽和化される(図1)10).すなわち,リノール酸の水酸化脂肪酸への水和(CLA-HYが触媒),水酸化脂肪酸の酸化(CLA-DHが触媒)と引き続く二重結合の転移によるエノンの生成(CLA-DCが触媒),さらには,エノンを構成する炭素-炭素二重結合への水素添加(CLA-ERが触媒)を経て,それまでの反応を折り返すように進行するカルボニル還元による水酸基の生成(CLA-DHが触媒),脱水反応(CLA-HYが触媒)による二重結合の生成を経て飽和化を完結する一連のルートを主経路とし,さまざまな水酸化脂肪酸,オキソ脂肪酸,共役リノール酸を生じる分岐路を伴った複雑な代謝経路が明らかにされた.さらに,α-リノレン酸やγ-リノレン酸などの炭素数18でΔ9位とΔ12位に二重結合を持つ不飽和脂肪酸を基質とした際にも,同様の代謝経路によりさまざまな水酸化脂肪酸やオキソ脂肪酸,共役脂肪酸,二重結合が一つ飽和化された部分飽和脂肪酸が生成することが明らかとなった.
2)その他の不飽和脂肪酸代謝
Lactobacillus属乳酸菌に見いだされた不飽和脂肪酸の飽和化代謝は,炭素数18の脂肪酸に対して特異的な,Δ9位の二重結合への水和反応によるC10水酸化脂肪酸の生成を起点とする代謝であったが,嫌気性細菌に幅広く飽和化代謝を探索することにより,さまざまな不飽和脂肪酸変換反応を見いだすことができた.
i)Δ12位の二重結合への水和反応を起点とする代謝
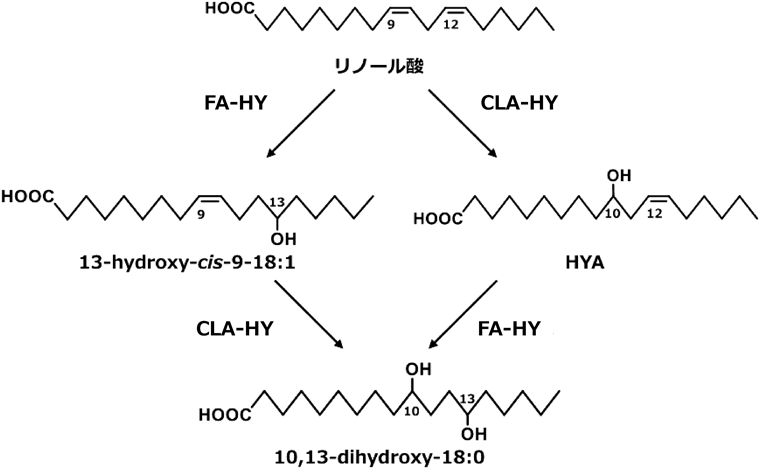
乳酸菌Pediococcus sp. AKU 1080によるリノール酸変換において,CLA-HY産物である10-hydroxy-cis-12-18 : 1(HYA)のみならず13-hydroxy-cis-9-18 : 1および10,13-dihydroxy-18 : 0が生成することを見いだした(図2)11).
ii)炭素数20の脂肪酸の代謝
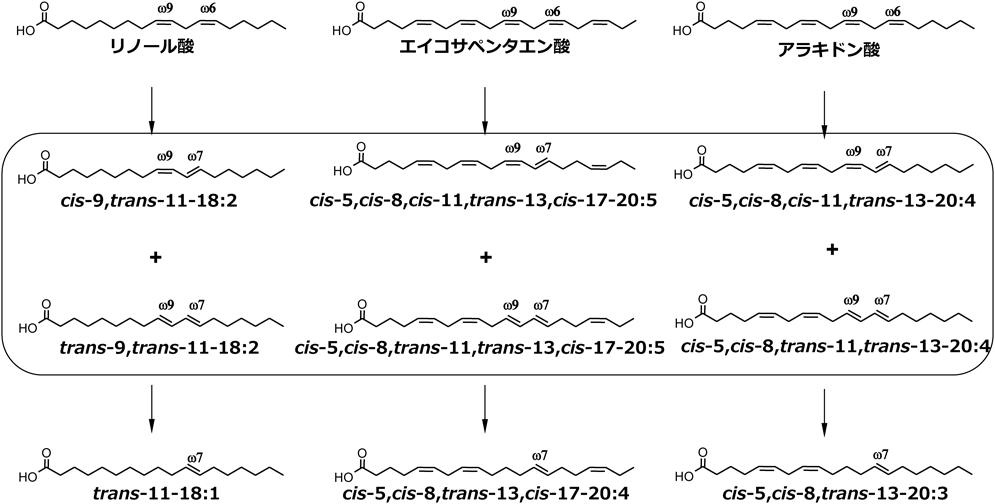
上述の乳酸菌による不飽和脂肪酸飽和化代謝は,炭素数18の脂肪酸に限定される.そこで,炭素数20の遊離型脂肪酸であるアラキドン酸[cis-5,cis-8,cis-11(ω9),cis-14(ω6)-eicosatetraenoic acid(20 : 4)]やエイコサペンタエン酸[EPA;cis-5,cis-8,cis-11(ω9),cis-14(ω6),cis-17-eicosapentaenoic acid(20 : 5)]を変換しうる微生物の探索を行った.その結果,嫌気性細菌Clostridium bifermentansの洗浄菌体(培養後の菌体を遠心分離により集菌し洗浄,再遠心分離した湿菌体)がアラキドン酸,EPAを変換することを見いだした12).
C. bifermentansの洗浄菌体を炭素数18のリノール酸や炭素数20のアラキドン酸,EPAを基質とする反応に供したところ,対応する共役脂肪酸の他に,基質よりも二重結合の数が一つ少ない脂肪酸の生成を確認した.これらの脂肪酸の構造解析を行ったところ,リノール酸からの生成物をtrans-11-18 : 1,アラキドン酸からの生成物をcis-5,cis-8,trans-13-eicosatrienoic acid(20 : 3),EPAからの生成物をcis-5,cis-8,trans-13,cis-17-20 : 4と同定した12).いずれの反応においても,基質として加えた脂肪酸が部分飽和化され,二重結合の数が一つ減少したユニークな部分飽和脂肪酸が生成した.また,反応における基質濃度の影響および経時変化の検討から,基質を飽和化する際の反応中間体として共役脂肪酸の生成が観察された.すなわち,C. bifermentansはcis-ω6,cis-ω9脂肪酸をtrans-ω7,cis-ω9およびtrans-ω7,trans-ω9共役脂肪酸へと変換した後,trans-ω7脂肪酸へと飽和化する代謝活性を有していた(図3).
3)不飽和脂肪酸飽和化代謝に関わる酵素群の諸性質
i)Δ9位特異的不飽和脂肪酸水和酵素
炭素数18の脂肪酸のΔ9位の二重結合への水和反応によるC10位水酸化脂肪酸の生成に関わるL. plantarum AKU 1009a由来CLA-HYは52 kDaの単量体酵素であり,FADを補酵素とし,NADHの添加により活性が上昇することを見いだした.本酵素により生産された10-hydroxy-cis-12-18 : 1, 10-hydroxy-cis-12,cis-15-18 : 2, 10-hydroxy-cis-6,cis-12-18 : 2の水酸基の立体構造を解析したところ,いずれもS体(99% e.e.以上)であり,立体選択性が高いことが明らかになった13).
ii)Δ12位特異的不飽和脂肪酸水和酵素
リノール酸を13-hydroxy-cis-9-18 : 1へ変換する酵素であるL. acidophilus NTV001由来のFA-HYはフラビン依存性酵素であり,FADの添加により水和活性が上昇した.基質特異性を検討した結果,リノール酸,α-リノレン酸,γ-リノレン酸を各々対応するC13位水酸化脂肪酸へ変換すること,ならびにC13位水酸化脂肪酸を基質とした脱水反応を触媒することを確認した.また,10-hydroxy-cis-12-18 : 1から10,13-dihydroxy-18 : 0を生成した.さらに本酵素は,炭素数18の脂肪酸のみならず,アラキドン酸(C15水酸化体を生成),ジホモ-γ-リノレン酸(C12ならびにC15水酸化体を生成)などの炭素数20の脂肪酸,さらには,炭素数22のドコサヘキサエン酸(DHA)(C14水酸化体を生成)にも作用した.本酵素により生産された13-hydroxy-cis-9-18 : 1, 13-hydroxy-cis-9,cis-15-18 : 2の水酸基の立体構造を解析したところ,それぞれR体,S体を選択的に生成していることが明らかになった14).
iii)水酸化脂肪酸脱水素酵素
水酸化脂肪酸からのオキソ脂肪酸の生成に関わる酵素CLA-DH(水酸化脂肪酸脱水素酵素)は,short-chain dehydrogenases/reductases familyに属する酵素であり,10-hydroxy-cis-12-18 : 1の10-oxo-cis-12-18 : 1への変換を可逆的に触媒する酸化還元酵素である.L. plantarum AKU 1009a由来CLA-DHは,32 kDaの単量体酵素であった.本酵素の酸化・還元反応における補酵素はNAD+·NADHであり,本酵素の還元活性は,酸化活性の約5倍であった.また,本酵素が,10位に水酸基を有する脂肪酸だけでなく,12位や13位に水酸基を有する脂肪酸にも作用する基質特異性の広い脱水素酵素である一方,2位や3位に水酸基を有する脂肪酸などの既知のアルコール脱水素酵素の基質には作用しない新規なアルコール脱水素酵素であることが明らかになった.還元反応により生成するアルコールにはS体,R体が共存しており,立体選択性が低いことが明らかになった15).
iv)エノン脂肪酸飽和化酵素
CLA-ERは,リノール酸飽和化代謝において10-hydroxy-trans-11-18 : 1のトランス型Δ11二重結合を飽和化して10-oxo-18 : 1を生成するエノンレダクターゼである.本酵素は,NADH oxidase/flavin reductase familyのなかでエノン脂肪酸の飽和化活性を示す唯一の酵素である.著者らは,FMNを補因子として有するホロ型CLA-ERの結晶構造解析により,本酵素のエノン脂肪酸認識様式を解明した.CLA-ERは特徴的なキャップ構造を有し,このキャップ構造がエノン脂肪酸結合時に大きな立体構造変化を起こすことを明らかにした.エノン脂肪酸結合部位は,片側が正に荷電した砂時計様の形状となっており,エノン型の遊離脂肪酸を認識するのに適した構造を有していた16).
v)不飽和脂肪酸飽和化代謝の腸内細菌分布
L. casei, L. rhamnosusといった乳酸桿菌には,cla-dh, cla-dc, cla-erから構成される遺伝子クラスターとcla-hyからなる不飽和脂肪酸飽和化代謝系酵素群のすべての遺伝子が,L. plantarumと同様に見いだされた.相同遺伝子は特に乳酸桿菌群に広く分布し,複数の相同遺伝子がL. salivarius(cla-hy, cla-dc, cla-er),L. amylovorus(cla-dh, cla-er),L. helveticus(cla-dh, cla-er),L. crispatus(cla-dh, cla-er),L. johnsonii(cla-dh, cla-er)に,いずれか一つの相同遺伝子がL. brevis(cla-hy),L. sakei(cla-hy),L. buchneri(cla-hy),L. gasseri(cla-er),L. acidophilus(cla-er)に見いだされた.乳酸桿菌以外にも,Enterococcus属(cla-hy),Clostridium属(cla-dhもしくはcla-dc),Brevibacillus属(cla-dh),Slackia属(cla-dc)の細菌に相同遺伝子が見いだされ,さまざまな腸内細菌に相同遺伝子が存在することが判明した10).
4. 腸内細菌が産生する不飽和脂肪酸代謝物の生理機能
乳酸菌由来脂肪酸変換酵素を発現する形質転換大腸菌を活用して不飽和脂肪酸代謝物を酵素合成し,培養細胞系やマウスを用いて,その生理機能解析を行った.以下に最近見いだした,代謝異常改善作用,バリア機能増強効果,抗炎症作用の詳細を述べる.これら以外にも,水酸化脂肪酸・オキソ脂肪酸に,核内受容体LXR(liver x receptor)のアンタゴニストとしての機能を介した脂質合成抑制17),エノン脂肪酸の転写調節因子Nrf2(NF-E2-related factor 2)を介した抗酸化18),HYAのHelicobacter pylori(ピロリ菌)への抗菌作用(ピロリ菌に特異的なメナキノン生合成系・フタロシン経路を阻害)など19),興味深い機能を見いだしている.
1)肥満に伴う代謝異常症の改善
代謝物のエネルギー代謝調節機構の鍵を握る分子として,脂質代謝制御などさまざまな生理現象に関与する核内受容体PPAR,ならびに,transient receptor potential vanilloid 1(TRPV1)に着目した.
PPARsの活性化作用について,培養細胞を用いたレポーターアッセイによる評価を行ったところ,食事脂質に由来する腸内細菌脂肪酸代謝物の多くがPPARαに対する強いアゴニスト活性を示した20).また,いくつかの腸内細菌脂肪酸代謝物はPPARγに対しても強いアゴニスト活性を示した.PPARα, PPARγの両者に対してデュアルアゴニストとして機能したリノール酸由来の代謝物10-oxo-cis-12-18 : 1(KetoA)に着目し(リノール酸はデュアルアゴニスト活性を示さない),前駆脂肪細胞3T3-L1の分化過程での添加効果を評価したところ,中性脂肪蓄積量,分化関連遺伝子の発現量が増加し,これらの作用はPPARγアンタゴニストの共添加により消失した.また,KetoA処理により,アディポネクチン分泌能,糖取り込み能の増強が認められた20).これらの脂肪細胞分化促進作用は,インスリン感受性細胞の数を増やし,抗糖尿病作用の発現につながる.続いて,肥満・糖尿病モデル動物であるKK-Ayマウスに対して4週間のKetoA混餌投与を行った.その結果,0.1% KetoA摂取群において,体重増加の抑制ならびに体脂肪蓄積の抑制が認められ,摂取開始2週目以降に血糖値の上昇抑制が認められた.また,血中中性脂肪量の低下も認められた.
TRPV1は交感神経活性化を介してエネルギー代謝を亢進する.そこで,腸内細菌脂肪酸代謝物のTRPV1活性化能および,それを介した生体内でのエネルギー消費亢進作用について検討した21).TRPV1活性化作用について,培養細胞を用いたカルシウムイメージングにより評価したところ,KetoAに強い活性化能を認めた.KetoAはパッチクランプにおいてもTRPV1を活性化することが明らかとなった.また,TRPV1の主な発現部位である感覚神経節から単離した神経細胞においてもKetoAはTRPV1を活性化することが認められた.そこで次に動物個体レベルでの作用を検討するため,食餌誘導性肥満モデル動物であるC57BL/6マウスに対する10週間の混餌投与を行った21).その結果,0.1% KetoA摂取群において,体重増加抑制・体脂肪蓄積抑制作用およびインスリンやレプチンなどの血中パラメータの改善が認められた.また,酸素消費量および直腸温の上昇が認められたため,褐色脂肪組織などにおいてエネルギー消費に重要な脱共役タンパク質1(UCP1)発現量について検討したところ,KetoA摂取群において,鼠径部白色脂肪組織におけるUCP1発現量の増加が認められた.一方,TRPV1ノックアウトマウスではKetoA摂取による上記の変化はいずれも認められなくなった.したがって,KetoA摂取はTRPV1活性化を介してエネルギー消費を亢進させることが示唆された21).
以上の結果から,KetoAはPPARα, PPARγ, TRPV1に対する活性化作用を有しており,KetoA摂取は肥満に伴う代謝異常症の予防・改善作用を示すことが示唆された.
2)水酸化脂肪酸の上皮細胞バリア機能増強効果
リノール酸の初期代謝物である水酸化脂肪酸10-hydroxy-cis-12-18 : 1(HYA)に,腸管上皮細胞やデキストラン硫酸ナトリウム(DSS)誘導性腸炎モデルマウスでのin vitroならびにin vivo評価において,脂肪酸受容体GPR40との相互作用を介してバリアの損傷を回復する機能が見いだされた22).
この成果に基づき,HYAが歯肉上皮バリア機能へ与える影響を評価した23).歯肉上皮細胞株Epi4における脂肪酸受容体GPR40の発現をPCR法および免疫染色にて確認した.HYAによるGPR40の活性化は,代表的な歯周病原性細菌であるPorphyromonas gingivalisによって誘発されるバリア機能低下を有意に阻害した.具体的には,上皮バリアの基本的な構成要素であるE-カドヘリンおよびβ-カテニンの分解が,in vitroでの評価において,HYAによりGPR40依存的に抑制された.加えて,歯周炎モデルマウスにおけるHYAの経口接種は,歯肉組織におけるE-カドヘリンの細菌誘発性分解およびそれに続く炎症性サイトカイン産生を抑制した23).
これらの結果は,HYAが腸炎や歯周病における炎症反応の抑制に寄与することを示すものであった.
3)水酸化脂肪酸,オキソ脂肪酸による抗炎症作用
HYAについては,マウス腸細胞ならびに骨髄系樹状細胞を用いたin vitro評価系において,炎症性サイトカインの産生を抑制することを見いだしている24).これらの結果から,HYAが腸管において抗炎症作用を示すことが期待された.また,HYAがTh1/Th2バランスを改善し,マウスのアトピー性皮膚炎様症状の悪化を抑えることが示された25).
一方,マクロファージモデル細胞RAW264.7細胞を用い,LPS刺激下で誘導される炎症性メディエーター,NOの産生能について評価を行った.その結果,リノール酸,α-リノレン酸,γ-リノレン酸由来の腸内細菌脂肪酸代謝物であるエノン型オキソ脂肪酸[それぞれ10-oxo-trans-11-18 : 1(KetoC),10-oxo-trans-11,cis-15-18 : 2(αKetoC),10-oxo-cis-6,trans-11-18 : 2(γKetoC)]に強い抗炎症活性が認められた.これらの脂肪酸は,LPS刺激したRAW264.7細胞から分泌されるTNF-α, MCP-1の発現についても,mRNA,タンパク質レベルで抑制した.肥満状態での脂肪組織で起こる炎症反応について検討するために3T3-L1脂肪細胞とRAW264.7マクロファージの共培養系および分化・肥大化させた3T3-L1脂肪細胞の培養液上清を用いて炎症性メディエーターの発現量を評価したところ,エノン型オキソ脂肪酸添加群において発現低下が認められた26).このように,マクロファージによる炎症性因子の産生を抑制するエノン型オキソ脂肪酸は,肥満状態の脂肪組織における慢性炎症状態を緩和する可能性が示唆された.
また,α-リノレン酸の代謝物が抗炎症性M2型マクロファージへの分化誘導を促進し,全身性の慢性炎症を緩和することが報告されている.そこで,α-リノレン酸ならびにその脂肪酸代謝物が,腸管粘膜免疫系に及ぼす影響について調べた27).その結果,α-リノレン酸の存在により腸管では特徴的にMCP-1が分泌され単球が腸管に遊走しうること,α-リノレン酸由来の腸内細菌脂肪酸代謝物である水酸化脂肪酸やオキソ脂肪酸が,腸管をTh2サイトカイン優位な環境に制御しM2型マクロファージへの分化誘導を促進することが示唆された.また,そのメカニズムとして,核内受容体PPARγや長鎖脂肪酸受容体GPR40の関与を観察した27).加えて,マウス(C57BL/6,雄)へのα-リノレン酸ならびにα-リノレン酸に由来する腸内細菌脂肪酸代謝物である水酸化脂肪酸やオキソ脂肪酸の経口投与(1 g/kg BW/day, 3日間)により,小腸粘膜固有層やパイエル板においてM2型マクロファージが有意に集積しているようすが観察された27).このような現象に起因して,肥大化した脂肪細胞などの慢性炎症の組織においてM2型マクロファージの浸潤が増加することは炎症抑制,ひいては生活習慣病の緩和につながると考えられた.
5. ヒト試験における水酸化脂肪酸の血糖値改善作用の評価
高血糖は血管内皮障害や炎症を引き起こすが,特に食後の数時間の血糖値の急上昇(血糖値スパイク)により血管が損傷し,動脈硬化が進み,心筋梗塞や脳梗塞のリスクが高まるといわれている.GPR40, GPR120のリガンドはインクレチン誘導を介した糖尿病の治療の標的として着目されており,GPR40, GPR120に対してアゴニスト活性を有するHYAに血糖値を改善する作用が期待できると考えられた.
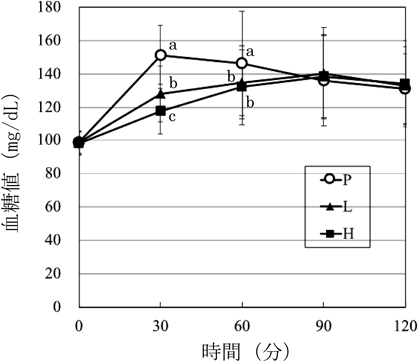
そこで,食後血糖値が上昇しやすい方60名を対象として,純度50%のHYAを含有するカプセル(HYA含有食品)を摂取したときの食後血糖への影響が検討された.試験デザインは3way-無作為化二重盲検クロスオーバー試験とし,プラセボ摂取群,HYA 1000 mg含有食品摂取群,HYA 2000 mg含有食品摂取群の3群を比較した.試験食品を水またはぬるま湯とともに噛まずに摂取させ,摂取後,負荷食品(米飯300 g)および補助食品(親子丼のもと210 g)を10分かけて摂取させた.負荷食品摂取前,摂取後30, 60, 90および120分後に採血し,血糖値を測定した.主要評価項目である血糖AUCは,HYAの低用量摂取(1000 mg),HYAの高用量摂取(2000 mg)ともに,プラセボと比較して有意に低値を示した.また,副次評価項目である負荷食品摂取後30分および60分の血糖値,血糖Cmaxも,プラセボと比較して,HYAを低用量および高用量摂取することで有意に低値を示した.以上の結果より,HYAを含有する食品を食直前に単回摂取することで,食後の血糖値上昇を有意に抑制することが確認された(図4)28).
このように,腸内細菌に新たな不飽和脂肪酸代謝が見いだされるとともに,その代謝物が宿主に移行し,宿主の脂肪酸組成に影響を与えていることが明らかとなった.また,代謝物に関して,代謝される前の食事由来脂肪酸にはみられない腸管バリア機能制御,脂肪酸合成・脂質代謝制御,免疫制御,炎症抑制など興味深い機能が見いだされた.これらの知見は,以前より抗炎症,抗肥満効果が報告されてきた不飽和脂肪酸と乳酸菌などの腸内細菌に関して,その機能発現の実態の一部を化合物レベルで説明しうるものである.
一方,2014年に水酸化脂肪酸の脂肪酸エステル(FAHFA)が抗炎症・抗糖尿病活性を有する新規な内因性脂質として報告された29).しかし,この脂質の部分構造である水酸化脂肪酸の由来は判明していない.水酸化脂肪酸が腸内細菌に由来する可能性,ならびに,FAHFAの生理機能が腸内細菌脂肪酸代謝物である水酸化脂肪酸,さらにはその代謝であるオキソ脂肪酸,エノン脂肪酸などに由来する可能性の検証にも興味が持たれる.
さまざまな生理活性が見いだされたHYAに関しては,機能性食品素材としての生産法開発にも取り組んでいる30).HYAは乳酸菌代謝を利用して植物油から作ることができ,乳酸発酵食品にも少量含まれていることから食経験もあり,安心かつ安全な素材である.HYAに腸管バリア保護機能,腸炎抑制機能が認められることから,HYAを機能性食品として継続的に摂取することで腸の健康を維持できると考えられる.また将来的には潰傷性大腸炎やクローン病などの対応困難とされている疾病の治療においても貢献できることを期待している.
HYA以外にも,炭素数18の食事由来脂肪酸(リノール酸,α-リノレン酸,γ-リノレン酸)や炭素数20の食事由来脂肪酸(アラキドン酸やEPA)に由来する多様な水酸化脂肪酸,オキソ脂肪酸,エノン脂肪酸,共役脂肪酸,部分飽和脂肪酸の生産が可能となっている6, 12, 31, 32).現在,これらの腸内細菌脂肪酸代謝物の生理機能や,生体にける腸内細菌脂肪酸代謝物の分布や濃度と内因的な生理機能の発現についての解析を行っているところである.これらの解析を通して,食事脂質の脂肪酸組成と腸内細菌の脂肪酸代謝活性の相互作用が健康維持において持つ役割が明らかになってくることを期待している.