エクソソームを代表とする小型細胞外小胞(small extracellular vesicle:sEV)は,細胞小器官の多胞体(multivesicular body:MVB)を介して放出されるナノメートルサイズの分泌小胞である.エクソソームにはタンパク質,mRNAやmiRNAが含まれており,細胞間の伝播を仲介することから,新しい細胞間伝達シグナルとして注目されており,各種疾患とも関係している.しかし,特定タンパク質がエクソソームへ輸送される機構は不明であった.
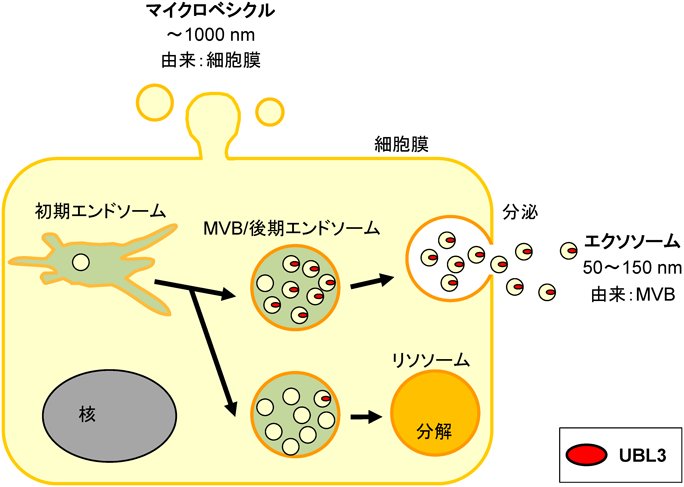
細胞外へ放出される分泌小胞は細胞外小胞(extracellular vesicle:EV)と総称され,細胞膜の一部が膨らみ直接分泌される細胞外小胞がマイクロベシクル(microvesicle),MVBを経由して分泌される細胞外小胞がエクソソームと呼ばれている(図1).マイクロベシクルには直径が1000 nmと巨大なものも含まれており,1万×gの遠心で精製される.一方,エクソソームは直径150 nm以下のナノサイズであるため,精製には10万×gの超遠心が必要である.ナノサイズのエクソソームは,がん細胞,間葉系幹細胞などほぼすべての細胞種から細胞外へ放出され,産生細胞に由来する特定のタンパク質やmiRNAを内包し標的細胞に再び取り込まれることで,新たな細胞間コミュニケーションとして働くことが知られている.さらに,エクソソームを介した伝搬は,がん転移や神経筋変性などの疾患を含めたさまざまな生命現象に関与していることが報告されている.
グリオーマ細胞で発現している活性型変異EGF受容体がエクソソームを介して伝搬することや,メラノーマから放出されたエクソソームに存在する受容体型チロシンキナーゼMETが転移へ関与することから,エクソソームはがん転移において非常に重要な役割を持つと考えられる.さらに,アルツハイマー病の発症に関わる因子と考えられているアミロイドβやタウ,プリオン病のプリオン,パーキンソン病でみられる凝集体の主要構成成分と考えられているα-シヌクレインなどもエクソソームへ取り込まれることが報告されている.このように,エクソソームを介した疾患増悪タンパク質の伝搬は,さまざまな疾患に関与することが知られていたが,どのような機構で特定タンパク質群がエクソソームへ輸送されるのかについては,完全には理解されていなかった.
筆者らの研究により,進化保存性の高いユビキチン様タンパク質ubiquitin-like 3(UBL3)が,新規翻訳後修飾(UBL3化と命名)を担うこと,UBL3化活性依存的に特定のタンパク質がエクソソームへと輸送されることが明らかとなった.さらに,網羅的プロテオミクス解析により,UBL3が少なくとも22個の疾患関連タンパク質と結合することを示しただけでなく,タンパク質の輸送系を応用した技術開発に対して新たな視点を提供することを示した1).
本稿では,ユビキチン様タンパク質とエクソソームへの特定タンパク質の輸送機構に関して,最新の研究知見も含めて紹介する.
mRNAから翻訳合成されたタンパク質は,細胞内や細胞小器官でリン酸基やアセチル基といった官能基やユビキチンなどの修飾因子が付加されることにより,分解,活性,輸送などの制御を受ける.
エクソソームへ輸送される一連のタンパク質も,リン酸化やアセチル化,ユビキチン化,脂質修飾などのさまざまな翻訳後修飾が付加されることが知られている.酸化,シトルリン化,リン酸化,アセチル化などの翻訳後修飾とエクソソームに関しては優れた総説があるので参照されたい2, 3).本稿では,ユビキチン様タンパク質による翻訳後修飾を介したタンパク質のエクソソームへの輸送制御に焦点を絞って紹介したい.
タンパク質のユビキチン化は,ユビキチン活性化酵素(E1),ユビキチン結合酵素(E2),ユビキチンリガーゼ(E3)の3種の酵素により行われる.ユビキチン化反応の特異性はE3ユビキチンリガーゼにより決定される.その後,修飾を受けたタンパク質はポリユビキチン化を特異的に認識する巨大タンパク複合体であるプロテアソームにより捕捉され,プロテアソーム内で分解される.ユビキチン修飾はタンパク質分解以外にも,エンドサイトーシスやDNA修飾やシグナル伝達など多彩な生命現象に関与することが知られている.
ユビキチンと相同な配列(ubiquitin-like domain)を持つタンパク質(SUMO, Nedd8, ISG15, ATG12)もまた翻訳後修飾因子として作用し,標的分子の輸送,機能活性調節,分解などに関与している.本稿では,ユビキチン,SUMO, ISG15, UBL3によるエクソソームへの制御機構について,近年の知見を交えて紹介する.
3. ユビキチン化とエクソソームへのタンパク質輸送について
エクソソームは,エンドサイトーシスで取り込まれた初期エンドソーム(early endosome)を起源とする.初期エンドソームはゴルジ体や小胞体と相互作用することで物質の分解や分泌を担っている.初期エンドソームから境界膜(limiting membrane)が陥入し,腔内膜小胞(intraluminal vesicle)を形成し,MVB/後期エンドソーム(late endosome)となる.そのMVBが細胞膜と融合すると,内包する腔内膜小胞がエキソサイトーシスによって細胞外へ分泌され,この分泌小胞がエクソソームと呼ばれている.一方,MVBがリソソーム(lysosome)と融合するとMVBの内容物は分解される(図1).
ポリユビキチン化されたタンパク質は,四つのユビキチン鎖を認識するプロテアソームに捕捉され分解される.一方,EGF受容体などの膜タンパク質は,細胞内領域にユビキチンが1分子付加するモノユビキチン化を受けることが知られ,モノユビキチン化された受容体は初期エンドソームへ輸送され,ESCRT(endosome sorting complex required for transport)複合体に認識され,MVBの腔内膜小胞に送り込まれる.最終的にはMVBがリソソームと融合することで分解される制御機構も知られている.MVBの腔内膜小胞への輸送の過程で,脱ユビキチン化活性が生じることから,MVB中の小胞には,モノユビキチン化されたタンパク質が含まれていないことが予想される.
Stoorvogelらの研究によって,エクソソーム中のタンパク質がポリユビキチン化されていることが判明した4).さらに,Pisitkunらによる網羅的プロテオミクス解析によって,エクソソーム中の同定タンパク質のうち15%がユビキチン化されており,それら同定されたユビキチン化タンパク質群を解析した結果,43%がモノユビキチン化,3%がマルチモノユビキチン化,54%がポリユビキチン化もしくは他の修飾を含むモノユビキチン化もしくはマルチモノユビキチン化されていることが報告された5).
ユビキチン化酵素のエクソソームへの輸送制御に関してはTanらの研究がある.E3ユビキチンリガーゼのアダプタータンパク質であるNdfip1(Nedd4 family-interacting protein 1)がエクソソームとして放出されること,Ndfip1の過剰発現によりE3ユビキチンリガーゼであるNedd4がエクソソームへ輸送され,エクソソーム中のタンパク質のユビキチン化が増大することが示された6).さらに,TanとHowittらの研究により,Ndfip1が認識するWW tagをCreタンパク質へ付加することにより,Creタンパク質の大部分がモノユビキチン化され,エクソソームへ輸送され,さらに機能を保っていることが示された7).
これらの研究成果から,エクソソームへ輸送されるタンパク質全体の15%はユビキチン化されており,一部のタンパク質はユビキチン化依存的にタンパク質輸送されていると考えられる.
4. SUMO化とエクソソームへのタンパク質輸送について
SUMOはsmall ubiquitin-related modifierの略称で,ユビキチン様構造を持つ分子として同定された.その後の多くの研究により,SUMOによる翻訳後修飾であるSUMO化はタンパク質の安定化,核-細胞質輸送,転写調節などの機能があることが報告された.
パーキンソン病において,α-シヌクレインの神経細胞への蓄積が神経細胞死を引き起こすことが知られている.Schneiderらの研究により,α-シヌクレインがエクソソームへ輸送されること,エクソソーム中のα-シヌクレインがSUMO化されていることが示された.さらに,彼らはSUMO化の活性を抑えることで,α-シヌクレインのエクソソームへの輸送が減弱することも示した8).
エクソソームは,タンパク質だけでなくmiRNAも含有し,伝搬させることが知られているが,タンパク質同様にRNAのエクソソームへの輸送機構は完全には理解されていない.
Sánchez-Madridらは,エクソソームへのRNA輸送機構を明らかにするために,精製エクソソームからmiRNAを精製し,塩基配列を決定後,系統樹解析を行った.その結果,共通するRNA motif配列(EXOmotif)を見いだした.EXOmotif配列を付加することで,エクソソームへの輸送が増大することが示された.さらに,EXOmotif配列に選択的に結合するタンパク質hnRNPA2B1を同定し,hnRNPA2B1によってEXOmotif配列による輸送が制御されていることが明らかとなった.hnRNPA2B1はエクソソームにおいてSUMO化されており,SUMO化によってhnRNPA2B1のmiRNAへの結合能が制御されていることは非常に興味深い9).つまり,miRNA輸送もSUMO化修飾によって間接的に輸送制御されている.
以上のことから,特定のタンパク質のエクソソーム輸送においては,SUMO化が重要な役割を持つと考えられる.
ISG15は,1979年にインターフェロンによって発現誘導されるユビキチン様タンパク質として同定された10).ISG15は,分泌因子としての作用と翻訳後修飾因子としての作用との二面性を持つことが知られている.
ISG15は,ユビキチンと同様にE1活性化酵素(Ube1L),E2結合酵素(UbCH8,UbCH6),E3リガーゼ(HERC5,HHARI,EFP)を介して翻訳後修飾ISGylationを引き起こすことが知られており,ISG15の発現により,ESCRT機構を介してHIVウイルスの出芽が阻害される11).
Sánchez-Madridらは,ウイルスとエクソソームの放出における分子機構に共通点があること,ESCRT複合体に含まれるTSG101がエクソソームに含まれること,TSG101がISGylationを受けるという研究報告から,エクソソームとISGylationの関連性を解析した.ISG15欠損マウスと不活性化型の脱ISG化酵素USP18発現マウスを用いた解析により,細胞内のMVB数とエクソソームの放出量は,ISG化活性によって負に制御されていることがわかった.さらに,エクソソーム放出量の減弱に,TSG101のISGylationが重要であることも示している12).
筆者らは,生物学的に重要な新規翻訳後修飾因子を探索するために,酵母,ショウジョウバエ,線虫,マウス,ヒトゲノムからubiquitin-like domainを含むタンパク質をすべて抽出し,系統樹解析により種間を超えて高度保存されているubiquitin-like proteinを10個見いだした.そのほとんどは,ユビキチン,SUMO, Nedd8などのすでに生理機能が知られている分子であった.しかしながら,UBL3に関しては機能が不明であったため,このタンパク質に着目して研究を開始した1).
UBL3は,マイクロアレイのメタ解析からヒトのさまざまな組織においてハウスキーピング遺伝子の一つとして同定され13),子宮頸がんのバイオマーカーとして報告されていた14).また,Vierstraらのグループは,ユビキチンと構造的に類似する種間保存性の高い分子としてmembrane-anchored Ub-fold protein(MUB)/UBL3を同定し,植物の系を用いて細胞膜への局在を示していたが,UBL3による翻訳後修飾に対する解析は皆無であった15).
一般的に,ユビキチンやSUMOやNedd8などのユビキチン様タンパク質は,C末端配列のGlyGly配列を介して標的分子のLys残基へイソペプチド結合することで翻訳後修飾が行われるため,その翻訳後修飾にはβ-メルカプトエタノールなどの還元剤処理によって解除されることはない.一方,UBL3は,C末端配列にGlyGly配列が存在せず,CysCys配列を介して標的タンパク質と結合し,その修飾は還元剤で解除される.つまりUBL3は,ユビキチンやSUMOやNedd8と同様にユビキチン様タンパク質の一種であるが,その翻訳後修飾様式は従来ユビキチンで知られていた様式とは大きく異なることが判明した1).
7. 新規翻訳後修飾UBL3化と特定タンパク質のエクソソームへの輸送について
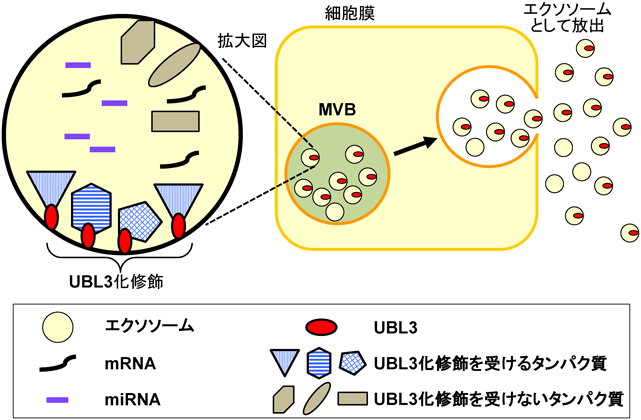
UBL3の機能的な側面を解析するために,筆者らはUBL3と各種細胞小器官マーカーとの共染色を行った.その結果,UBL3は他の細胞小器官に比べMVBマーカーであるCD63との強い共局在を示すことを見いだした.このことから筆者らは,UBL3のエクソソームへの関与を検討した.その結果,UBL3のMVBへの局在化とエクソソームへの輸送にはUBL3化活性が必須であり,UBL3ノックアウトマウスから精製した血清エクソソームは,野生型に比べエクソソームに含まれる全タンパク質量が60%も減弱していることが明らかとなった.
UBL3が新規翻訳後修飾因子として機能し,エクソソームへのタンパク質輸送に関与することがわかってきた.それでは,どのようなタンパク質が,UBL3化により輸送制御を受けるのであろうか? この疑問に答えるべく,筆者らはUBL3結合タンパク質同定のために網羅的プロテオミクス解析を行った.Flagタグのみ,Flagタグが付加されたUBL3, Flagタグが付加されたUBL3化活性を持たないUBL3変異体をそれぞれ細胞へ導入し,Flag抗体により免疫沈降を行い,抗体ビーズ内トリプシン消化(on-bead digestion)を行った後,ラベルフリーでの定量プロテオミクス解析を行った.その結果,野生型UBL3に特異的に結合する分子が1241個同定された.Gene Ontology Cellular Component(GOCC)解析により,同定分子の細胞内局在を調べたところ,UBL3結合タンパク質群の31%がextracellular vesicular exosomeとアノテーションされていた.さらに,興味深いことに,UBL3結合分子群の中にRasやmTORなどの疾患関連タンパク質が少なくとも22個含まれていることが判明した.
次に,これらのUBL3結合分子群がUBL3化修飾を受けるのかを検証した.モデルケースとして,UBL3結合分子に含まれていた細胞骨格タンパク質であるチューブリンと,がん原遺伝子として知られているRasを選択し解析を行った.その結果,チューブリンもRasもUBL3による翻訳後修飾を受けるのみならず,UBL3修飾依存的にエクソソームへの輸送が増大するという非常に興味ある知見を見いだした.さらに,発がん性RasG12V変異体もUBL3による翻訳後修飾を受け,エクソソームへの輸送量が増大した.このエクソソームを培養細胞へ投与すると,取り込まれた細胞においてRASシグナルの伝播が生じることを確認した.この結果は,UBL3によってエクソソーム輸送された発がん性RasG12V変異体は,活性を維持しており,エクソソームを介した細胞間コミュニケーションによって,エクソソームを受け取った細胞側でRASシグナルを上昇させることが可能であることを意味している.
以上のことから,新規翻訳後修飾であるUBL3活性がエクソソームへのタンパク質輸送を制御していることが判明した(図2).
9. エクソソームへの輸送タグとしてのUBL3の有用性
最後に,UBL3化を介したタンパク質のエクソソームへの輸送機構を利用することで,任意のタンパク質をエクソソームへ封入させること,すなわち輸送タグとしてのUBL3の有用性を検証した.任意のタンパク質としてGFPを用い,ユビキチン,SUMO1, SUMO2, UBL3を輸送タグとしてGFPに融合させてMVBへの局在解析を行った.その結果,ユビキチン,SUMO1, SUMO2を付加したGFPは,MVBマーカーであるCD63とほとんど共局在を示さないが,UBL3を付加したGFPは有意にCD63と共局在することを見いだした.さらに,ユビキチン,SUMO1, SUMO2, UBL3を付加したGFPをそれぞれ導入した細胞からエクソソームを精製し,エクソソーム内のGFP量をイムノブロットで評価したところ,UBL3を付加したGFPが容易に検出されるのに比較して,ユビキチン,SUMO1, SUMO2を付加したGFPのシグナルは非常にわずかであることがわかった.さらに,UBL3をmCherryやビオチン化タンパク質へ付加して同様の実験を行ったところ,UBL3融合タンパク質が精製エクソソームから検出されることがわかった.
放出されたエクソソームは,再び他の細胞に取り込まれる特性から新たなドラッグデリバリーの担い手としても注目されている.したがって,我々の実験結果から,UBL3は他のユビキチン様修飾因子と比較して,エクソソームへの輸送タグとして,非常に有益であると考えられる.
エクソソームによる細胞間コミュニケーションは,がん転移や神経筋変性などを含めたさまざまな疾患に関与することが知られている.現在のがんに対する治療では,外科手術,抗がん剤を用いた化学療法,放射線療法,免疫療法等の治療法を組み合わせ,治療効果の高い集学的治療を行うことが多い.そのため,エクソソームを介した細胞間コミュニケーションに対する阻害も,新しい治療戦略の一つとして注目されている.
エクソソームへのタンパク質輸送は,ユビキチン,SUMO, ISG15, UBL3などのユビキチン様タンパク質による翻訳後修飾が重要な役割をしていることから,これらの反応系に対する阻害剤も新しい治療戦略の一つになる可能性が大いにある.さらに,筆者らの研究により,mTORなどを含む22個の疾患関連タンパク質がUBL3結合タンパク質として同定されたことから,がん転移以外の疾患に対しても,UBL3修飾の阻害剤の探索は新しい治療戦略につながると期待される.
謝辞Acknowledgments
本稿で紹介した研究成果を発表するにあたり,大変お世話になりました多くの先生方に,この場を借りて深謝します.また,本研究成果は,文部科学省科学研究費・基盤研究(C)(18K07209 and 16K08599),基盤研究(B)(19H03427),新学術領域研究(19H05299),公益財団法人市原国際奨学財団,公益財団法人大隅基礎科学創成財団,国立研究開発法人国立精神・神経医療研究センター精神・神経疾患研究開発費(29-4)の研究助成を受けている.
引用文献References
1) Ageta, H., Ageta-Ishihara, N., Hitachi, K., Karayel, O., Onouchi, T., Yamaguchi, H., Kahyo, T., Hatanaka, K., Ikegami, K., Yoshioka, Y., et al. (2018) UBL3 modification influences protein sorting to small extracellular vesicles. Nat. Commun., 9, 3936.
2) Szabo-Taylor, K., Ryan, B., Osteikoetxea, X., Szabo, T.G., Sodar, B., Holub, M., Nemeth, A., Paloczi, K., Pallinger, E., Winyard, P., et al. (2015) Oxidative and other posttranslational modifications in extracellular vesicle biology. Semin. Cell Dev. Biol., 40, 8–16.
3) Moreno-Gonzalo, O., Fernandez-Delgado, I., & Sanchez-Madrid, F. (2018) Post-translational add-ons mark the path in exosomal protein sorting. Cell. Mol. Life Sci., 75, 1–19.
4) Buschow, S.I., Liefhebber, J.M., Wubbolts, R., & Stoorvogel, W. (2005) Exosomes contain ubiquitinated proteins. Blood Cells Mol. Dis., 35, 398–403.
5) Huebner, A.R., Cheng, L., Somparn, P., Knepper, M.A., Fenton, R.A., & Pisitkun, T. (2016) Deubiquitylation of Protein Cargo Is Not an Essential Step in Exosome Formation. Mol. Cell. Proteomics, 15, 1556–1571.
6) Putz, U., Howitt, J., Lackovic, J., Foot, N., Kumar, S., Silke, J., & Tan, S.S. (2008) Nedd4 family-interacting protein 1 (Ndfip1) is required for the exosomal secretion of Nedd4 family proteins. J. Biol. Chem., 283, 32621–32627.
7) Sterzenbach, U., Putz, U., Low, L.H., Silke, J., Tan, S.S., & Howitt, J. (2017) Engineered exosomes as vehicles for biologically active proteins. Mol. Ther., 25, 1269–1278.
8) Kunadt, M., Eckermann, K., Stuendl, A., Gong, J., Russo, B., Strauss, K., Rai, S., Kugler, S., Falomir Lockhart, L., Schwalbe, M., et al. (2015) Extracellular vesicle sorting of alpha-Synuclein is regulated by sumoylation. Acta Neuropathol., 129, 695–713.
9) Villarroya-Beltri, C., Gutierrez-Vazquez, C., Sanchez-Cabo, F., Perez-Hernandez, D., Vazquez, J., Martin-Cofreces, N., Martinez-Herrera, D.J., Pascual-Montano, A., Mittelbrunn, M., & Sanchez-Madrid, F. (2013) Sumoylated hnRNPA2B1 controls the sorting of miRNAs into exosomes through binding to specific motifs. Nat. Commun., 4, 2980.
10) Farrell, P.J., Broeze, R.J., & Lengyel, P. (1979) Accumulation of an mRNA and protein in interferon-treated Ehrlich ascites tumour cells. Nature, 279, 523–525.
11) Okumura, A., Lu, G., Pitha-Rowe, I., & Pitha, P.M. (2006) Innate antiviral response targets HIV-1 release by the induction of ubiquitin-like protein ISG15. Proc. Natl. Acad. Sci. USA, 103, 1440–1445.
12) Villarroya-Beltri, C., Baixauli, F., Mittelbrunn, M., Fernandez-Delgado, I., Torralba, D., Moreno-Gonzalo, O., Baldanta, S., Enrich, C., Guerra, S., & Sanchez-Madrid, F. (2016) ISGylation controls exosome secretion by promoting lysosomal degradation of MVB proteins. Nat. Commun., 7, 13588.
13) Chang, C.W., Cheng, W.C., Chen, C.R., Shu, W.Y., Tsai, M.L., Huang, C.L., & Hsu, I.C. (2011) Identification of human housekeeping genes and tissue-selective genes by microarray meta-analysis. PLoS One, 6, e22859.
14) Huang, L., Zheng, M., Zhou, Q.M., Zhang, M.Y., Yu, Y.H., Yun, J.P., & Wang, H.Y. (2012) Identification of a 7-gene signature that predicts relapse and survival for early stage patients with cervical carcinoma. Med. Oncol., 29, 2911–2918.
15) Downes, B.P., Saracco, S.A., Lee, S.S., Crowell, D.N., & Vierstra, R.D. (2006) MUBs, a family of ubiquitin-fold proteins that are plasma membrane-anchored by prenylation. J. Biol. Chem., 281, 27145–27157.
著者紹介Author Profile
 上田 洋司(あげた ひろし)
上田 洋司(あげた ひろし)藤田医科大学総合医科学研究所難病治療学助教.理学博士.
略歴1973年3月大阪府に生る.95年京都産業大学物理学科卒業,98年九州大学大学院理学研究科生物学専攻修士課程修了,2001年九州大学大学院医学系研究科分子生命化学博士課程修了,同年三菱化学生命科学研究所-特別研究員,06年三菱化学生命科学研究所副主任研究員,09年より現職.
研究テーマと抱負新規翻訳後修飾UBL3化による分子制御機構.我々が見出した新規翻訳後修飾因子UBL3は,少なくとも22個の疾患関連タンパク質と相互作用する.このことから,UBL3化を基軸にした疾患治療薬の開発を展開したい.
ウェブサイトhttp://info.fujita-hu.ac.jp/~nanbyou/
趣味美術館めぐり,ボードゲーム,パズル収集.
 土田 邦博(つちだ くにひろ)
土田 邦博(つちだ くにひろ)藤田医科大学総合医科学研究所難病治療学教授.医学博士.
略歴1962年9月愛知県に生る.92年京都大学大学院医学研究科博士課程修了,92~95年米国ソーク生物学研究所研究員,95~98年京都大学医学部分子遺伝学教室・助手,98~2005年徳島大学分子酵素学研究センター(現先端酵素学研究所)助教授,05年より現職.
研究テーマと抱負治療困難な疾患の病態解明と治療法開発,ナノメディシン,分子細胞生物学.先端技術が次々に取り入られ変貌していく生命医科学研究の中で,普遍的な原理を明らかにしたい.
ウェブサイトhttp://info.fujita-hu.ac.jp/~nanbyou/
趣味音楽鑑賞,ウクレレ演奏.