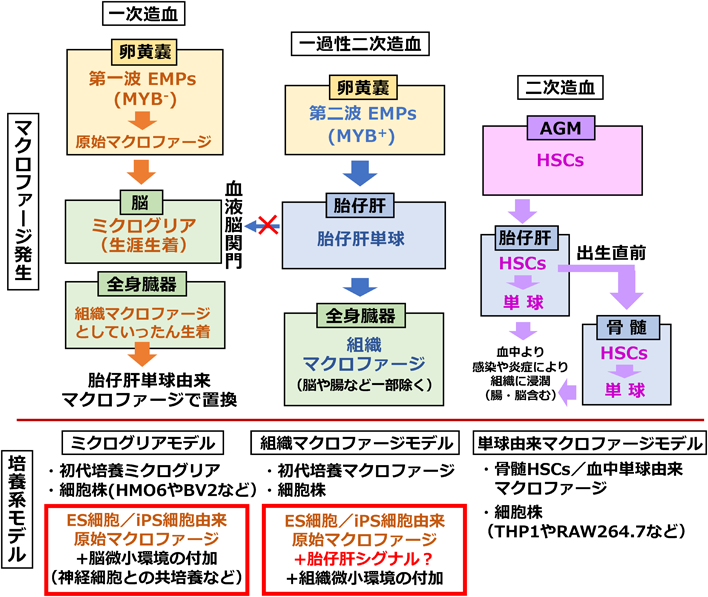
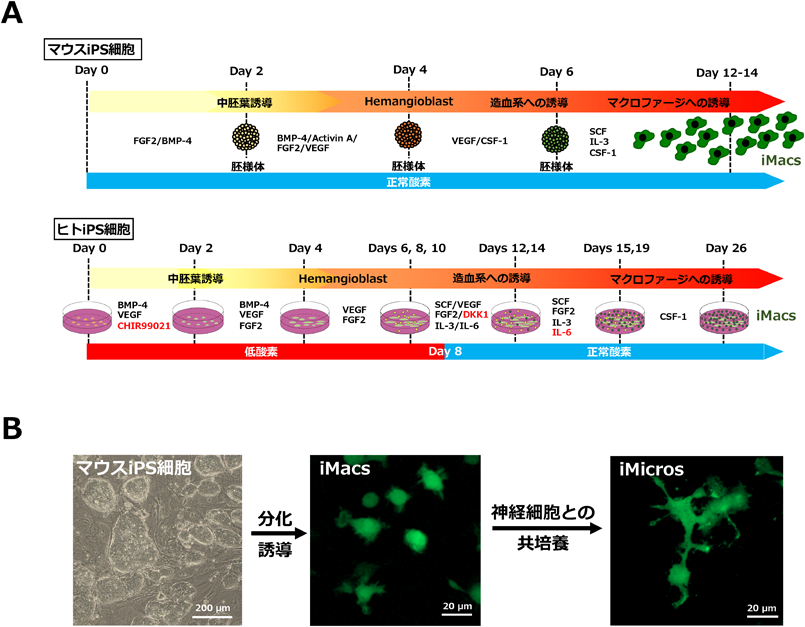
iPS細胞由来原始マクロファージ様細胞分化誘導法の開発とその可能性iPS cell-derived macrophages for future studies
京都薬科大学統合薬科学系Division of Integrated Pharmaceutical Sciences, Kyoto Pharmaceutical University ◇ 〒607–8414 京都市山科区御陵中内町5 ◇ 5 Nakauchi-cho, Misasagi, Yamashina-ku, Kyoto 607–8414, Japan