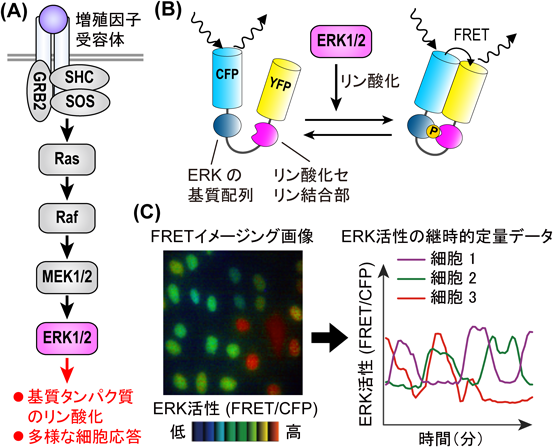
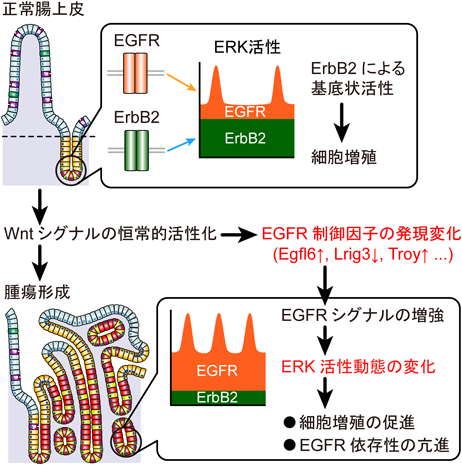
生体内におけるERK MAPキナーゼ活性の動態と生理的意義In vivo dynamics of ERK MAP kinase activity and their physiological significance
1 京都大学大学院生命科学研究科生体制御学分野Laboratory of Bioimaging and Cell Signaling, Graduate School of Biostudies, Kyoto University ◇ 〒606–8315 京都府京都市左京区吉田近衛町 ◇ Yoshida-konoe-cho, Sakyo-ku, Kyoto 606-8315, Japan
2 京都大学大学院医学研究科病態生物医学分野Department of Pathology and Biology of Diseases, Graduate School of Medicine, Kyoto University ◇ 〒606–8315 京都府京都市左京区吉田近衛町 ◇ Yoshida-konoe-cho, Sakyo-ku, Kyoto 606-8315, Japan
3 北海道大学化学反応創成研究拠点(WPI-ICReDD)Institute for Chemical Reaction Design and Discovery (WPI-ICReDD), Hokkaido University ◇ 〒001–0021 北海道札幌市北区北21条西10丁目 北海道大学化学反応創成研究拠点(WPI-ICReDD) ◇ Kita 21 Nishi 10, Kita-ku, Sapporo, Hokkaido 001–0021, Japan