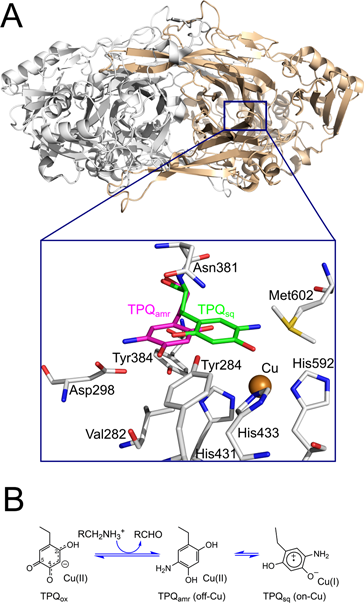
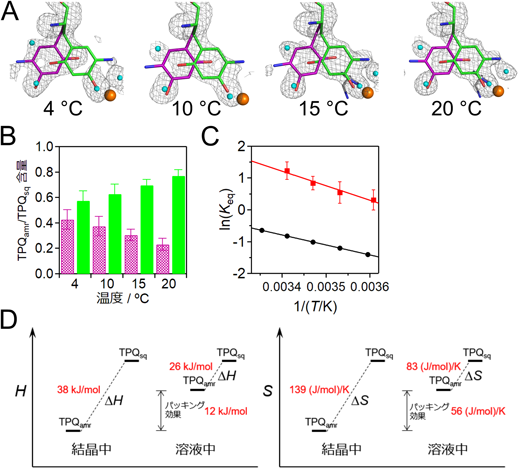
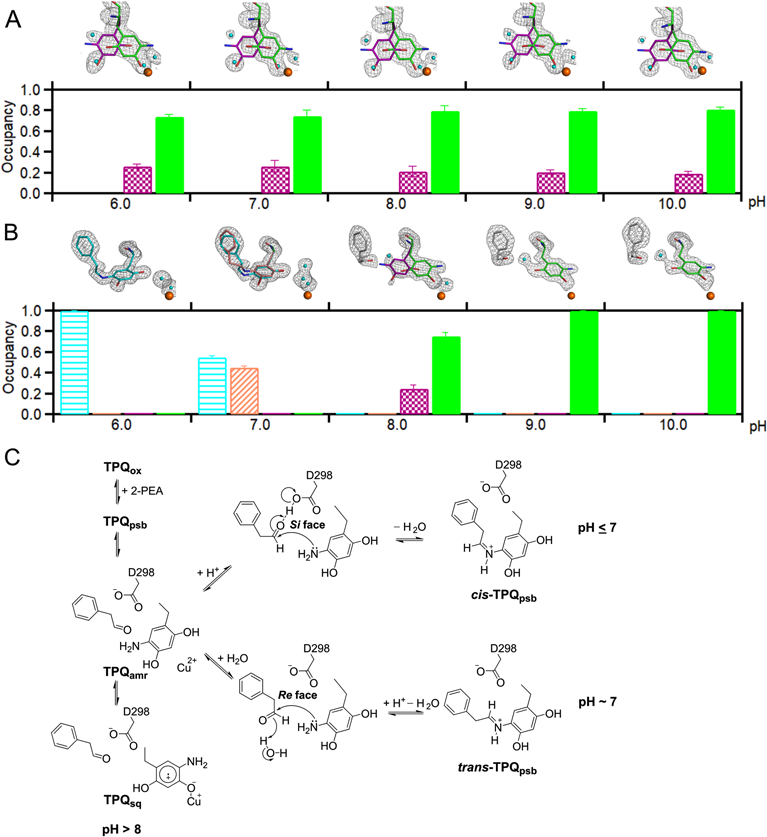
銅含有アミン酸化酵素触媒反応におけるコンホメーション変化のin crystallo熱力学解析In crystallo thermodynamic analysis of the cofactor conformational change induced during the catalytic reaction of copper amine oxidase
1 大阪医科大学生化学教室Department of Biochemistry, Osaka Medical College ◇ 〒569–8686 大阪府高槻市大学町2–7 ◇ 2–7 Daigakumachi, Takatsuki, Osaka 569–8686, Japan
2 高輝度光科学研究センタータンパク質結晶解析推進室Protein Crystal Analysis Division, Structure Analysis Promotion Group, Japan Synchrotron Radiation Research Institute ◇ 〒679–5198 兵庫県佐用郡佐用町光都1–1–1 ◇ 1–1–1 Kouto, Sayo-cho, Sayo-gun, Hyogo 679–5198, Japan
3 大阪大学産業科学研究所生体分子反応科学研究分野Department of Biomolecular Science and Reaction, Institute of Scientific and Industrial Research, Osaka University ◇ 〒567–0047 大阪府茨木市美穂ケ丘8–1 ◇ 8–1 Mihogaoka, Ibaraki, Osaka 567–0047, Japan