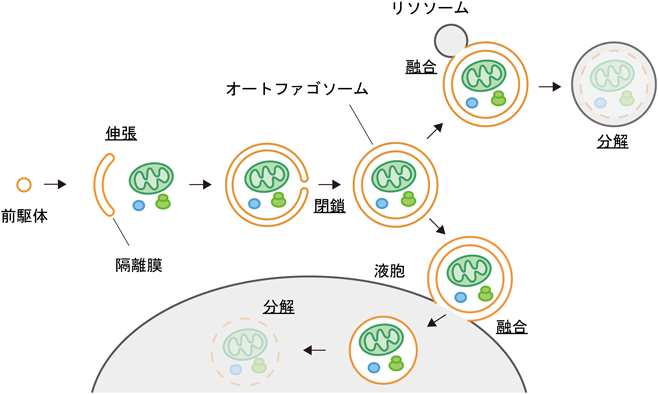
マクロオートファジーにおいては,さまざまな細胞成分が“オートファゴソーム”と呼ばれる二重膜小胞(2枚の脂質二重層で仕切られた小胞)内に隔離され,リソソームあるいは液胞に輸送され,分解される1, 2)(図1).オートファゴソームは“隔離膜”と呼ばれる扁平な膜小胞が湾曲しながら球状に伸展して形成される.この過程で,湾曲した隔離膜の凹面に結合する分子やオルガネラなどは“選択的”に,隔離膜の凹面側に偶然存在した細胞質は“非選択的”にオートファゴソーム内に封入されることになる3–5)(選択的オートファジーについては小松の稿,松田の稿を参照).細胞の種類や条件にもよるが,直径1 µm程度のオートファゴソームが約10分で完成する.このダイナミックな膜現象に多くの研究者が興味を持ち,その謎の解明に取り組んできた.大隅良典博士は,出芽酵母Saccharomyces cerevisiaeを用いてオートファゴソームの形成に必要なautophagy-related(ATG)遺伝子/タンパク質を発見し,これらの分子機能や細胞内動態を解析し,オートファゴソーム形成の分子メカニズムを明らかにしてきた.その業績が評価され,2016年,大隅博士はノーベル生理学・医学賞を受賞した.しかし,マクロオートファジーのメカニズムには,本稿で議論するように,まだ基本的な問題が解明されずに残されている.それでも,最近の研究により全容解明の糸口がみえてきたように思われる.本稿では,そのような成果を中心に,オートファゴソーム形成機構の最新像を概説する.
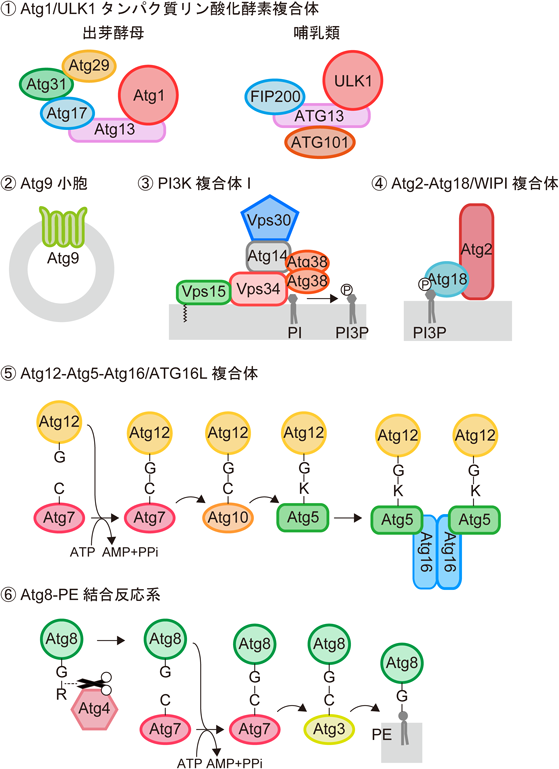
Atgタンパク質には,分解標的のオートファゴソームへの選択的取り込みに関わるもの(オートファジー受容体など)も含まれるが,オートファゴソームの形成に関わるものは“コア”Atgタンパク質と呼ばれる3, 4).コアAtgタンパク質は六つの機能ユニット,すなわち,①Atg1/ULK1タンパク質リン酸化酵素複合体,②Atg9/ATG9小胞,③ホスファチジルイノシトール3–キナーゼ複合体I(PI3K複合体I),④Atg2–Atg18/ATG2-WIPI複合体,⑤Atg12–Atg5–Atg16/ATG12-ATG5-ATG16L複合体(以下,Atg16/ATG16L複合体),⑥Atg8ファミリータンパク質–ホスファチジルエタノールアミン(PE)結合反応系を構成している(スラッシュの後は哺乳類ホモログの名称)(図2).マクロオートファジーが誘導されると,これらの機能ユニットはまず,オートファゴソーム形成の場に集積し,pre-autophagosomal structure(PAS)を構築する6).オートファゴソーム形成の場は,出芽酵母では液胞と小胞体の近傍6),哺乳類では小胞体上(特にミトコンドリアとの接触部位)とされているが7–9),これらがどのように決定されるのかは不明である.
オートファジーは細胞内外のさまざまな環境変化や分解標的の出現などを引き金として誘導されるが10),ここではオートファジーが強く誘導される栄養(アミノ酸)飢餓におけるメカニズムを述べていく.出芽酵母のAtg1複合体は,Atg1, At13, Atg17, Atg29, Atg31からなる11, 12).Atg17, Atg29, Atg31は恒常的に複合体を形成しているが,富栄養条件では,Atg13がTorキナーゼ複合体1(TORC1)によってリン酸化され,Atg1およびAtg17との相互作用が阻害されることでAtg1複合体の形成が抑制されている13–15).飢餓に伴いTORC1の活性が低下すると,Atg13が脱リン酸化状態となり,Atg1複合体が形成される13, 14).さらに,Atg1複合体内のAtg13が別のAtg1複合体内のAtg17と結合することで複合体間を架橋し,複数のAtg1複合体からなる超会合体が形成され,これがPAS構築の“足場”となる16)(詳細は野田の稿を参照).ULK1, ATG13, FIP200, ATG101からなる哺乳類のULK1複合体もTORC1によるリン酸化を介した制御を受けるが,出芽酵母のAtg1複合体とは異なり,複合体形成のステップでは制御されていないようである17–20).また,ULK1複合体もオートファジーの誘導に応じて集合するが8, 21),Atg1複合体にみられるようなメカニズムで超会合体を形成するかについては不明である.
Atg1複合体による足場が形成されると,Atg13のHORMAドメインとAtg9との相互作用を介してAtg9小胞がPASに招集される22).Atg9小胞は膜タンパク質であるAtg9が積み込まれたゴルジ体由来の直径50 nmほどの膜小胞である23, 24).Atg9小胞は長らくオートファゴソーム形成における膜の供給源と考えられてきた.この考えと合致して,隔離膜および完成したオートファゴソームの膜にもAtg9の存在が確認された23, 25).しかし,一つのオートファゴソームを形成する間にAtg9小胞は数個程度しか招集されないことから,Atg9小胞は主要な膜供給源ではなく,オートファゴソーム膜を形成するための“シード”となっていると考えられる23).Atg9小胞は続いてPASに局在化してくる他の因子の働きでその組成や形態を変化させ,“隔離膜前駆体”となると考えられるがその詳細は不明である.哺乳類では,ATG16Lを含む小胞とATG9を含む小胞が細胞膜から別々に形成され,ATG16L陽性小胞はATG16L陽性小胞どうしでの融合を経て,リサイクリングエンドソームにてATG9陽性小胞と融合し,オートファゴソーム前駆体となることが提唱されているが26, 27),広く受け入れられているとはいいがたい.
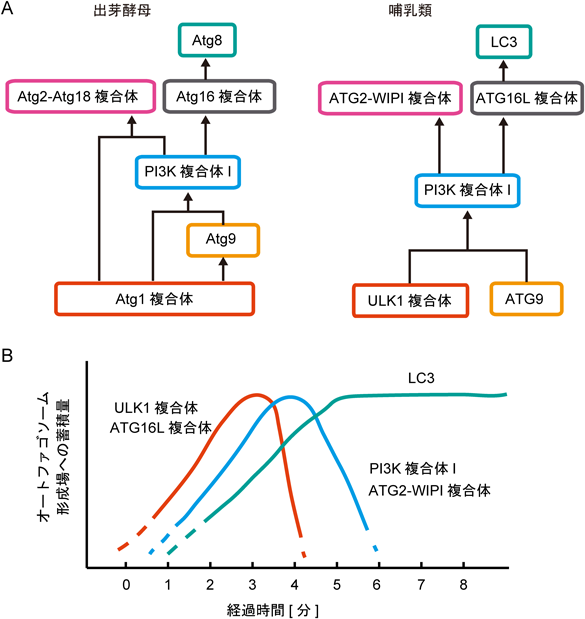
PAS/オートファゴソーム形成場へのAtgタンパク質の局在化については,遺伝学的ヒエラルキー解析や局在化の経時的解析の結果に基づき,逐次局在化モデルが提唱されている8, 28, 29).遺伝学的ヒエラルキー解析から示唆されるモデルでは,Atg9/ATG9に続いてPI3K複合体Iが局在化し,これに依存してAtg2–Atg18/ATG2-WIPI複合体とAtg16/ATG16L複合体が局在化し,最後にAtg16/ATG16L複合体に依存して,Atg8/LC3が局在化する(図3A).一方,経時的解析(哺乳類細胞)では,ULK1複合体とATG16L複合体がほぼ同時に,続いてPI3K複合体IとATG2–WIPI複合体がほぼ同時に,そして最後にLC3が局在化するようすが観察されている(図3B).遺伝学的ヒエラルキー解析では,各ATG遺伝子の破壊細胞における各Atgタンパク質のPAS局在が系統的に調べられたが,遺伝学的に上流に位置する因子は時間的にも先に局在化するであろうという仮定の上での考察であるため,実際の局在順序と合致しない可能性がある.一方,経時的解析は,局在化した(十分に集積した)との判断が蛍光観察の感度やタンパク質ごとの集積量の違いといった要素に影響を受けると考えられるため,やはり実際の局在順序と合わない可能性がある.実際に,Atg8ファミリータンパク質やAtg16/ATG16L複合体はAtg1/UKL1複合体と直接相互作用することが報告されており30, 31),蛍光顕微鏡では見逃される量のこれらのタンパク質がPAS形成のごく初期にPASに局在化し,機能している可能性が考えられる.PASの形成機構を理解するためには,Atgタンパク質のPAS/オートファゴソーム形成場への局在化機構をタンパク質間相互作用あるいはタンパク質–脂質間相互作用のレベルで解明し,これらの相互作用がPAS形成の進行に従ってどのように変化していくのかを明らかにしていく必要がある.
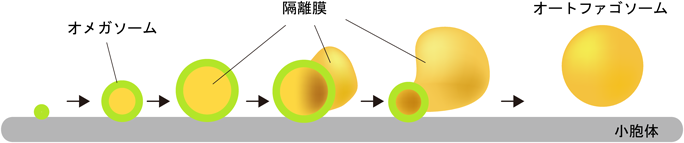
オートファゴソームの膜の起源は,オートファジーのメカニズムの研究における最大の謎の一つとしていまだに議論がつきない32, 33).上述したように,Atg9小胞はオートファゴソームを形成する膜成分の一つといえるが,主要な膜成分は他から供給されると考えられる.これまで,小胞体7, 34, 35)やミトコンドリア36)など,複数のオルガネラがオートファゴソーム形成における膜の供給源であると提唱されてきた.しかしながら近年,小胞体とオートファゴソーム形成との密接な関係が明らかにされてきた.まず,哺乳類細胞において,Atgタンパク質が小胞体上で集積すると,小胞体の一部がホスファチジルイノシトール3-リン酸(PI3P)陽性のリング状のドメインを形成することが蛍光顕微鏡で捉えられた7).このリング状の構造体は“オメガソーム”と名づけられ,このリング内の膜が突き出すように伸張して隔離膜となるモデルが提唱された(図4).また,電子線トモグラフィーにより,小胞体が隔離膜に張りつくように存在し,ところどころで隔離膜と連結していることも示された34, 35).さらなる電子線トモグラフィーによる解析の結果,小胞体と隔離膜の開口端が多くの細いチューブでつながっているようすが観察された.オメガソームの超微細形態が捉えられたと考えられ,これらのチューブを介して小胞体の脂質が隔離膜に流入するというモデルが提唱された37).
出芽酵母においては,隔離膜の伸張端が小胞体のCOPII小胞形成部位(ER exit site:ERES)と近接していることが示された25, 38).COPII小胞は,小胞体で合成されたタンパク質などをゴルジ体へ輸送するための小胞である39).COPII小胞の形成やCOPII小胞とゴルジ体との融合に関わる因子の変異体においてはオートファゴソーム形成が不全となる38, 40–42).また,オートファジー誘導条件においてCOPIIタンパク質であるSec24がHrr25(カゼインキナーゼ1δ)によってリン酸化され,Atg9と相互作用するようになること,この相互作用がオートファゴソーム形成に重要であることが報告された43).これらの結果は,COPII小胞が隔離膜に融合し,その膜の伸張に寄与する可能性を示唆するものであるが,これに関する実験的証拠は得られていなかった.
あるオルガネラの形成において,別のオルガネラから脂質あるいは膜貫通型膜タンパク質が流入することを示せば,これは後者が前者の形成における膜供給源であることを示す端的な証拠となりえる.しかしながら,COPII小胞の積荷タンパク質に蛍光タンパク質を融合しても,その融合タンパク質の隔離膜やオートファゴソームへの局在化が観察されたことはなかった.最近,理化学研究所の黒川量雄博士,中野明彦博士のグループは,出芽酵母においてCOPII小胞を可視化するシステムを構築した44).このシステムでは,COPII因子の温度感受性変異株において,積み荷膜タンパク質Axl2(出芽に関わる細胞膜タンパク質)にGFPを付加し,熱応答性SSA1プロモーター下で発現させる.この細胞を23°C(許容温度)で培養すると,COPII小胞は形成され,Axl2-GFPの発現は抑制される.培養温度を37°C(非許容温度)に上げると,Axl2-GFPの発現が誘導されるが,COPII小胞の形成が停止し,Axl2-GFPは小胞体に蓄積する.ここから温度を再び23°Cに下げると,Axl2-GFPで高度に標識されたCOPII小胞が形成される.我々はこの系を利用し,Axl2-GFPが小胞体からCOPII小胞への積み込みに依存してオートファゴソームの膜(内容物としてではなく)や隔離膜上に移行することを蛍光顕微鏡および免疫電子顕微鏡解析により示すことに成功した45).すなわち,COPII小胞がオートファゴソーム形成における膜供給源の一つである実験的証拠を提示した.これにより,「COPII小胞は主要な膜供給源であるのか?」「COPII小胞は膜伸張の材料として使われているのか? あるいは膜伸張に重要な特定の脂質やタンパク質の供給を担っているのか?」など,さらなる課題が明確に提示されることとなった.哺乳類においても,蛍光顕微鏡下においてオートファゴソーム関連膜(LC3の輝点)とERESの近接が観察されること38, 46)や,ULK1複合体のサブユニットであるFIP200がCOPIIタンパク質であるSEC12と相互作用すること47)が報告されており,COPII小胞がオートファゴソーム形成において膜を供給していることが示唆される.哺乳類細胞においてもこの可能性について明確な答えが得られることが期待される.
COPII小胞は本来ゴルジ体に向かうべき小胞である.COPII小胞はどのようにしてオートファゴソーム形成の場へリクルートされるのだろうか? 前述したAtgタンパク質とCOPIIタンパク質との相互作用がこのプロセスを担っている可能性がある.また,隔離膜とERESとの物理的な近接によってCOPII小胞の隔離膜へのターゲティングが効率的に起こるのかもしれない.(おそらくはSNAREタンパク質を介する)融合のメカニズムも今後明らかにすべき重要な課題である.
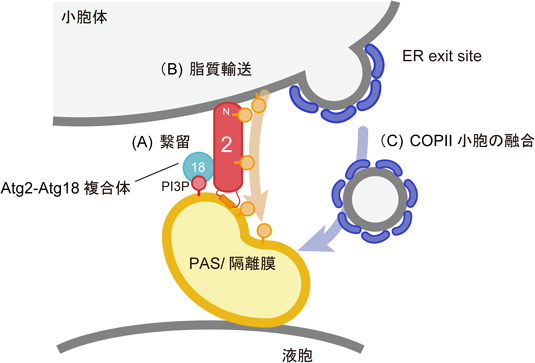
隔離膜と小胞体とのコンタクトサイト形成の分子基盤について,最近大きな進展があった.以前より,出芽酵母において,隔離膜と小胞体(ERES)のコンタクトサイトにAtg2–Atg18複合体が局在化することが見いだされていたが25, 38),同複合体の分子機能は長らく不明であった.特に,PI3P結合タンパク質であるAtg18は複合体のPASへの局在化に重要であることがわかっていたが48),Atg2に関する情報はほとんど得られていなかった.我々は,出芽酵母のAtg2のドメイン解析を行い,Atg2がN, C両末端に独立して機能する二つの膜結合ドメインを持つことを発見した49).酵母細胞から単離したAtg2と人工膜小胞を用いて,Atg2にはこれらの二つの膜結合ドメインを介して二つの膜をつなぎ合わせる機能があることを示した.C末端側の両親媒性αヘリックスはAtg2自身の膜結合に関与する他,Atg18とPI3Pを含む膜との結合を促進することを明らかにした.このヘリックスを欠損したAtg2変異体は,Atg18との複合体は形成するが,PASへの局在化能を失う.すなわち,C末端側の両親媒性αヘリックスは,Atg18とともに,Atg2–Atg18複合体のPASへの結合(局在化)を担うことが示唆された.一方,N末端領域の欠失変異体は,複合体形成およびPASへの局在化には異常を示さなかったが,隔離膜の伸張に欠損がみられた.また,Atg2のN末端46残基をGFPに融合すると小胞体への局在化がみられ,オートファゴソーム形成能が失われる変異をこのN末端領域内に導入すると,融合タンパク質は細胞質に局在するようになった.さらに,N末端欠失変異体に小胞体膜タンパク質であるSec71の膜貫通領域を付加すると,部分的ではあるもののオートファジーの活性が回復した.これらの結果は,間接的ではあるが,Atg2のN末端領域は小胞体膜への結合に関与しており,このようなAtg2の機能は隔離膜の伸張に重要である可能性を示唆している.以上の結果から,Atg2–Atg18複合体はPAS/隔離膜を小胞体につなぎ止める役割を担うことを提唱した49)(図5A).我々の報告と前後して,哺乳類のATG2にも膜をつなぎ止める機能があることが示されたが50),哺乳類細胞においては,ATG2-WIPI複合体と小胞体との関係はまだ明らかになっていない.今後の解析が待たれる.
一方で,ごく最近,Atg2には膜を繋留するだけでなく,脂質分子を膜から引き抜いて別の膜に輸送する活性(lipid transfer protein活性)があることが複数のグループによって報告された51, 52, 53)(詳細は野田の稿を参照).以上の結果をまとめると,Atg2–Atg18複合体は,隔離膜を小胞体のERES近傍につなぎ止め,脂質を直接小胞体から隔離膜へと輸送している可能性がある(図5B).また,ERESで形成されたCOPII小胞がAtg2–Atg18複合体のごく近傍で隔離膜と融合していることも想像される(図5C).Atg2–Atg18複合体による繋留がCOPII小胞の隔離膜への融合に重要であるかについてはまだ調べられていない.また,COPII小胞を介した膜輸送とAtg2による脂質輸送との関係も不明である.さらに,哺乳類においては,小胞体からオメガソームを介して隔離膜に膜が供給される可能性もある.今後,これらの複数のメカニズムの関係や連携の研究も重要になってくるだろう.
隔離膜が伸展し,球状になるにつれて,開口部は収縮していく.最終的には極小となった開口部で膜分裂(membrane fission)が起こり,隔離膜が閉じる(図1).この過程は,膜融合反応と捉えられることもしばしばあった.しかし,この過程がエンドソーム/多胞体(multivesicular body)での内腔小胞のくびり切りの過程と同等であることや,1枚の膜である隔離膜(扁平な膜小胞)が,開口部の閉鎖後,2枚の膜(オートファゴソームの外膜と内膜)に分かれることを考えると隔離膜の閉鎖は膜分裂と呼ぶべき過程であることが理解されるだろう54).この隔離膜の閉鎖のメカニズムも長らく未解明であったが,最近,ESCRT(endosomal sorting complex required for transport)がこの過程に関わることが報告された.ESCRTはもともと,エンドソーム/多胞体での内腔小胞の形成に必要な因子として同定されたが,その後,細胞膜からのウイルス粒子の出芽,細胞膜損傷の修復,細胞分裂時の細胞膜の切断,細胞分裂後の核膜再形成など,さまざまなプロセスにおける膜分裂を担うことが明らかにされてきた55).隔離膜の閉鎖も同様のプロセスであることから,以前よりESCRTの関与が予測されていたが,最近,哺乳類において,ESCRTが隔離膜の開口部に局在化し,その閉鎖を促進することが示された56).また,出芽酵母においても,ESCRTに依存して隔離膜の閉鎖が起こることが報告された57).哺乳類細胞におけるESCRTの招集機構は不明であるが,出芽酵母においては,ESCRT IIIのサブユニットであるSnf7がAtg1複合体のサブユニットであるAtg17と相互作用することが示されている57).
本稿では,オートファゴソーム形成における前駆体膜の形成から隔離膜の閉鎖までのメカニズムについて,現時点で我々の理解するところを概説した.ここでは章を立てて述べなかったが,完成したオートファゴソームとリソソーム/液胞の融合機構が解明されたこともオートファジーのメカニズムに関する最近の大きな進展の一つである.哺乳類では,完成したオートファゴソームにR-SNAREであるSyntaxin 17およびYkt6がリクルートされ,可溶性のSNAP29やリソソームに存在するQ-SNAREタンパク質,Rab7およびHOPS複合体とともに,オートファゴソームとリソソームの融合を引き起こす58, 59).出芽酵母においても,オートファゴソーム上のYkt6が液胞上のSNAREタンパク質(Vam3, Vam7, Vti1),Ypt7(Rab7ホモログ)およびHOPS複合体とともにオートファゴソームと液胞の融合を媒介する60, 61).オートファゴソームとリソソーム/液胞との融合機構および隔離膜の閉鎖機構についてはその大枠は解明されたといってよいだろう.一方,前駆体の形成機構および隔離膜の伸張機構については本稿で述べてきたようにいまだ重要な疑問が多く残されている.さらなる解析が必要であることはいうまでもない.しかし,オートファゴソーム形成機構の研究はその全容解明に向けて,着実に前進している.