もし読者の皆様が細胞内の機能を自由に創り出せるとしたら,リソソームでタンパク質や核酸を分解する際に,細胞質の分解基質をどのようにリソソーム内に輸送するだろうか.おそらく,トランスポーターのような分子を介して基質をリソソーム膜通過させるというのは,真っ先に思いつく方法の一つではなかろうか.それにもかかわらず,このような「膜透過型オートファジー」の研究は,マルチモードオートファジーのなかでも立ち遅れており,詳細はまだまだ謎に包まれている(以前筆者らは膜動態を伴わないという意味で,非小胞輸送型オートファジーと呼んでいたが,小胞輸送や膜輸送が膜動態を伴う輸送と等しいかはあいまいであり,変更した).現在,膜透過型オートファジーに分類されるオートファジーとしては,特定のタンパク質が基質となるシャペロン介在性オートファジー(chaperone-mediated autophagy:CMA)とRNAまたはDNAが基質となるRNautophagy, DNautophagyが知られている1, 2).RNautophagy, DNautophagyは筆者らが発見したオートファジーであり,本稿では,その分子メカニズムを中心にこれまでの研究を紹介する.
2. RNautophagy, DNautophagyとは
発見の経緯については,以前,『生化学』85巻12号(2013)の総説で紹介したので,より詳細に関してはそちらを参照されたい3).ここでは概要を述べる.筆者らは「単離リソソームと精製RNAまたはDNAを,ATPを含む溶液中で混合し37°Cで数分間インキュベーションすると,核酸がリソソーム内部に取り込まれ分解される」という新しい現象を見いだした.このように,リソソームに直接的にRNAおよびDNAが取り込まれ分解される経路をそれぞれRNautophagy, DNautophagyと名づけた(RNautophagy and DNautophagy:RDA)4, 5).
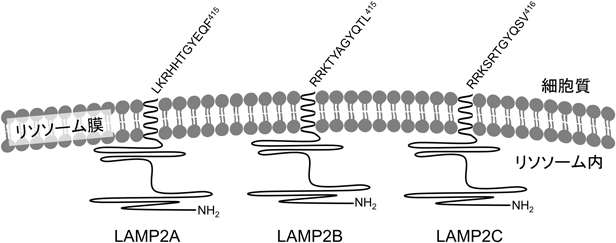
また,同時にリソソーム膜タンパク質LAMP2Cの細胞質側配列が核酸と直接結合することを示した4, 5).LAMP2CはLAMP2のスプライス・バリアント(LAMP2A, LAMP2B, LAMP2C)産物の一つである6).LAMP2は1回膜貫通型のリソソーム膜タンパク質であり,タンパク質の大部分を占めるリソソーム内ドメインはN末端側に位置し,バリアント間で膜直下領域を除き同一のアミノ酸配列からなる.一方,細胞質側領域はバリアント間で異なる配列となっている(図1).筆者らの研究結果では,LAMP2Aの細胞質側配列はまったく核酸と結合せず,LAMP2Bの細胞質側配列は核酸結合能を有するがLAMP2Cの結合能より弱く,実験条件によっては結合しない4, 5).LAMP2Aに関しては,CMAにおいて基質タンパク質と結合し受容体として機能すると報告されている7).
筆者らは,LAMP2CのRDAへの関与について検討,解析した.LAMP2C過剰発現細胞から単離したリソソームでは,核酸の取り込み活性が上昇し,LAMP2 knockout(KO)マウス由来の単離リソソームでは,核酸の取り込み活性が低下したことから,LAMP2CはRDAを仲介することを明らかにした4, 5).培養細胞レベルの実験では,HeLa細胞にLAMP2A, LAMP2B, LAMP2Cをそれぞれ過剰発現させ,3H-ウリジンを用いたパルスチェイス実験により細胞内RNA分解を測定したところ,空ベクターを導入した対照細胞と比較して,LAMP2C過剰発現細胞でのみRNA分解の上昇が観察された4).また,LAMP2C mRNAの発現量は,解析したマウス組織のなかで脳において一番高く,LAMP2 KOマウス脳では野生型と比較して脳重量あたりのRNA量が増加していた4).以上の一連の結果から,LAMP2CはRDAにおいて核酸受容体の一つとして機能することを示した.ここでの受容体とは,基質に結合し基質のリソソームへの取り込みを仲介するという,CMAにおける定義7)に準じている.また,RNautophagyは細胞レベルや動物個体レベルでも機能していることが示唆された.DNautophagyに関しては現在までのところ,単離リソソームにおける現象にとどまっており,細胞レベルなどで今後の研究が必要である.
LAMP2Cの短い細胞質配列はどのように核酸と結合するのであろうか.典型的な核酸結合モチーフの一つであるアルギニンリッチモチーフは,約10~20アミノ酸残基の配列中に複数のアルギニン残基を含むモチーフであり,アルギニン残基が直接核酸と結合する8, 9).アルギニンは側鎖にグアニジニウム基という官能基を有しており,これにより核酸のグアニンやリン酸基などと水素結合のネットワークを構築できるという,他の塩基性アミノ酸にはない特徴を持っている.LAMP2Cの細胞質配列にはアルギニン残基が複数存在し,これらのアルギニンをセリンに置換した細胞質配列ペプチドはRNAやDNAとの結合性をまったく示さなかった10).このことから,LAMP2C細胞質配列と核酸の結合には,LAMP2Cのアルギニンリッチ配列が必要であることがわかった.
筆者らは他のリソソーム膜タンパク質,LAMP2B, LAMP1, LAMP4/CD68の細胞質側配列もアルギニンリッチ配列を有し,核酸結合能があることを見いだしており10)(LAMP2Bに関しては上述),これらのタンパク質もRDAにおいて核酸受容体として機能する可能性はある.
4. RDAにおける核酸取り込みに基質の選択性は存在するのか?
LAMP2Cの細胞質側配列が,どのような核酸配列や塩基に結合するのかを調べる目的で,A, C, G, Uそれぞれの塩基のみから構成されるオリゴヌクレオチド,poly-A, poly-C, poly-G, poly-U(15塩基RNA)を作製し,LAMP2Cペプチドとの結合性をプルダウンアッセイにより解析した.このような単純な実験で明確な結果が得られるとは期待していなかったが,結果として,LAMP2Cペプチドはこれらのうちpoly-Gのみと結合し,poly-A, poly-C, poly-Uとはまったく結合しなかった11).DNAオリゴヌクレオチドを用いて実験した場合もまったく同様の結果で,LAMP2Cペプチドはpoly-dGに結合し,poly-dA, poly-dC, poly-dTとはまったく結合しなかった.
さらに単離リソソームを用いて,これらのオリゴヌクレオチドがRDAによってリソソームに移行するか調べたところ,poly-G, poly-dGはATP存在下でリソソームに移行したのに対し,poly-A, poly-C, poly-U, poly-dA, poly-dC, poly-dTはまったく移行しなかった11).これらの実験においては,LAMP2Cの核酸結合選択性と,単離リソソームにおけるRDAの基質選択性が完全に相関したのである.以上の研究結果から,in vitroにおいてRDAは完全に非選択な経路ではないことが明らかとなった.また,基質核酸がリソソーム膜上の核酸結合タンパク質と結合することが,RDAに必要であることが強く示唆されたとともに,研究結果は,LAMP2Cが核酸受容体として機能するというモデルを支持している.
LAMP2Cペプチドとpoly-G, poly-dGの結合に必要な塩基数についても検討を行った.プルダウンアッセイの実験条件下では,poly-dGについては4塩基,poly-Gについては6塩基で有意な結合性があった.dGの4塩基連続配列を含む二本鎖DNAもLAMP2C結合性があった.poly-Gについては,4塩基でもわずかに結合する傾向はあったこと(有意差はなし),(GGGGCC)のリピートRNAはLAMP2Cペプチドと結合したことから11),細胞内のRNA配列中においては,4塩基のGGGG配列でもLAMP2C結合モチーフとして機能する可能性はある.細胞レベルにおける核酸中の認識配列や基質選択性,GやdGの連続配列以外のLAMP2C結合配列に関しては,今後の検討課題である.
筆者らはRDA発見当初から,LAMP2Cはトランスポーターではないと考えていた.というのも,これまでに知られているトランスポーターはすべて複数回膜貫通タンパク質だからである12).そこで筆者らは核酸トランスポーター機能にひもづけられている分子についてGene Ontologyデータベース上から検索を行った.その結果,Caenorhabditis elegans (C. elegans)SID-1(systemic RNA interference defective-1)とその脊椎動物オルソログSIDT1, SIDT2がRNAトランスポーター機能にひもづけられていた.
SID-1は以前,C. elegansにおけるsystemic RNAiに必要な遺伝子・タンパク質の一つとして同定された13).複数回膜貫通タンパク質であり,SID-1を発現させた培養細胞を用いて,SID-1は細胞外の二本鎖RNA(dsRNA)を細胞内に取り込む機能を有することが見いだされた14).その後,SID-1を発現させた培養細胞と電気生理学的手法(ホールセルパッチクランプ法)を用いた実験の結果,dsRNA依存的な電流値の変化が観察され,SID-1はdsRNAのトランスポーターであることが報告された15).SID-1依存的なdsRNAの細胞外への輸送も観察され,SID-1は双方向性に機能することが明らかとなった15).さらに興味深いことに,SIDT2がリソソームに局在するという報告が複数あった16–18).筆者らは,SIDT2がRNautophagyにおけるRNAトランスポーターとして機能すると予測し,SIDT2に関する研究を開始した.
GFPを付加したSIDT2を用いて,筆者らもSIDT2が主にリソソームに局在することを確認した.また,単離リソソームをトリプシン処理することにより,SIDT2がリソソーム膜タンパク質であることを生化学的に示した19).次に,SIDT2を過剰発現させた細胞と対照細胞からリソソームを単離し,精製RNAを基質として,SIDT2過剰発現のRNautophagyへの影響を解析した.生化学的解析および免疫電子顕微鏡法による解析の結果,SIDT2の過剰発現によりRNautophagyにおけるRNAのリソソームへの取り込み活性が増加した.また,反対にSIDT2のノックダウンの影響を調べたところ,RNAのリソソームへの取り込み活性が減少した.SIDT2の過剰発現やノックダウンは,リソソームのpHや溶解したリソソームによるRNA分解活性に影響しなかった19).以上の結果から,SIDT2はRNautophagyにおいてリソソームによる核酸取り込みを仲介することが明らかとなった.
SID-1ではSer-536がRNAトランスポート機能に必要であることがわかっている14, 15).筆者らは,Ser-536に相当するSIDT2のSer-564をアラニン残基に置換し(S564A),RNautophagy活性への影響を解析したところ,S564A SIDT2の過剰発現は単離リソソームにおけるRNA取り込み活性に影響しないことを見いだした19).この結果から,Ser-564はSIDT2によるリソソームへのRNA取り込みに必要であることがわかった.また以上の一連の結果とSID-1がRNAトランスポーターであるという報告を併せ,SIDT2はRNautophagyにおいて,リソソーム膜上のRNAトランスポーターとして機能していることが示唆された.
DNAを用いた実験により,RNAと同様の結果が得られたことから20),SIDT2はDNautophagyにおいてもリソソームによる核酸取り込みを仲介することが明らかとなり,SIDT2はRDAにおいて,リソソーム膜上の核酸トランスポーターとして機能していることが示唆された.
細胞レベルにおけるRNA分解の解析も実施した.マウス胎仔線維芽細胞(mouse embryonic fibroblast:MEF)において,SIDT2をノックダウンし,3H-ウリジンを用いたパルスチェイス実験により細胞内の全RNA分解への影響を解析した.驚いたことに,SIDT2ノックダウンにより最大で約50%の細胞内RNA分解が阻害された19).また,リソソーム阻害剤であるクロロキン添加でも同程度までRNA分解が阻害され,クロロキン存在下ではSIDT2ノックダウンによる有意なRNA分解阻害は観察されなかった.マクロオートファジーが起こらないAtg5 KO MEFにおいても同様の結果が得られ,SIDT2ノックダウンにより顕著にRNA分解が阻害され,クロロキン存在下では有意な分解阻害は観察されなかった19).これらの結果は,細胞レベルにおけるSIDT2を介したRNA分解はリソソームによる分解であり,マクロオートファジーとは別経路であることを示している.単離リソソームの結果も併せ,SIDT2は細胞レベルにおいてもRNautophagyを仲介すると考えられた.また,少なくともMEFにおいてRNautophagyは細胞内RNA分解の主要経路の一つであることが示唆された.
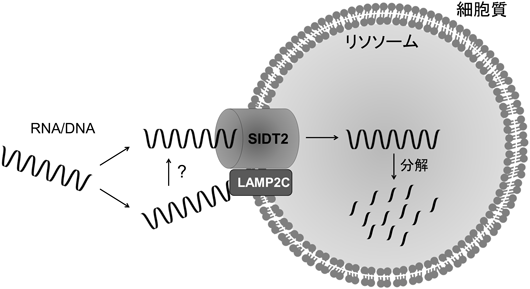
LAMP2CとSIDT2にはRNautophagyにおいてどのような関係性があるのであろうか.共免疫沈降法により両タンパク質の相互作用を調べた結果,両者はともに免疫沈降され19),LAMP2CとSIDT2は間接的あるいは直接的に結合できることがわかった.SIDT2の活性にLAMP2Cが必要であるか検討するために,LAMP2 KO HeLa細胞を作製し,SIDT2を過剰発現させ,単離リソソームにおけるRNA取り込みへの影響を解析した.その結果,LAMP2 KO HeLa細胞由来単離リソソームにおいても,SIDT2過剰発現によるRNA取り込み活性の増加が観察された19).すなわち,RNautophagyにおけるSIDT2の機能にLAMP2Cは必須ではないことが明らかとなった.ただし,SIDT2機能をLAMP2Cが増強する可能性はあり,両者の関係性について現在さらなる解析を行っているところである.現在のところ,SIDT2が核酸トランスポーターとして機能し,LAMP2Cは核酸結合能を介して取り込み増強などの補助的な役割をしているというモデルを考えている(図2).また,前述のin vitroにおけるRDAの基質選択性とLAMP2Cの核酸結合性が相関するという点と矛盾するようにも感じられるかもしれないが,これについては他の核酸結合タンパク質で説明がつくと考え,研究を進めている.
前述のように,SID-1の脊椎動物オルソログにはSIDT1とSIDT2の2種類が存在する.精製リソソームに存在するタンパク質を質量分析により網羅的に解析した複数の論文において,SIDT2はリソソームに存在するが,SIDT1は検出されていない16, 18).SIDT1はリソソームに局在するタンパク質ではないと考えられたが,筆者らは,SIDT1がRNautophagyに関与するかしないかについても検討を行った.SIDT1にGFPを付加してNeuro2a細胞内における局在を解析したところ,SIDT1はリソソームにはほとんど局在しなかった.また,野生型SIDT1を過剰発現させたNeuro2a細胞由来の単離リソソームにおいて,RNautophagy活性に変化はなかったことから19),少なくともNeuro2a細胞においてSIDT1はRNautophagyに直接関与しないと結論した.
8. SIDT2過剰発現の細胞内RNA分解への影響
SIDT2の過剰発現により,細胞レベルでのRNautophagy活性が上昇するかどうかを検討した.野生型SIDT2を,Neuro2a細胞に過剰発現させ,パルスチェイス実験により細胞内の全RNA分解への影響を解析した.その結果,SIDT2の過剰発現により,細胞内RNA分解が約1.5~2倍上昇した21).リソソーム阻害剤であるバフィロマイシンA1存在下では,SIDT2の過剰発現による細胞内RNA分解上昇は観察されなかったことから,SIDT2によるRNA分解促進はリソソーム分解を介していることが確認された.筆者らの知る限りでは,細胞内タンパク質の単独過剰発現により細胞内RNAを顕著に分解できるという例はこれまでになく,初めての報告である.
なお,C末端にタグを付加したSIDTs(SIDT1およびSIDT2)には核酸の輸送活性がないことを確認している(未発表データ).C末端に蛍光タンパク質などのタグを付加したSIDTsを用いた実験でSIDTsの機能を研究した論文も存在するが,その解釈には注意が必要であると筆者は考えている.
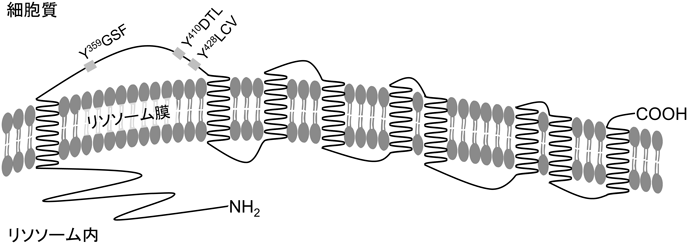
RDAのメカニズム解明研究の一つとして,SIDT2のリソソーム局在化機構について研究を行った.主要なリソソーム局在化シグナルの一つとしてYXXΦモチーフが知られている.SIDT2の細胞質側配列を検索したところ,三つのYXXΦモチーフ(YGSF, YDTL, YLCV)が存在した(図3).そこで,三つのYXXΦモチーフに変異を導入した変異体(3YS変異体)を作製し,GFPタグを付加してNeuro2a細胞における細胞内局在を観察した.解析の結果,3YS変異体はリソソームに局在せず,三つのYXXΦモチーフがSIDT2のリソソーム局在に必要であることを明らかにした21).3YS変異体の約50%はゴルジ体に蓄積した.また,共免疫沈降法を用いてSIDT2はモチーフの一つ,YGSFを介してアダプタータンパク質複合体(adaptor protein complexes)であるAP-1およびAP-2と相互作用することを示した.このことからYGSFモチーフを介するSIDT2のリソソーム局在制御はAP-1とAP-2を介して行われていることが示唆された.さらに,三つのモチーフによるSIDT2のリソソーム局在は,単離リソソームにおいても細胞レベルにおいても,SIDT2を介するRNautophagyの活性に必要であることを示した21).
SIDT2の三つのYXXΦモチーフをSIDT1に導入したSIDT13YXXΦ変異体を作製し解析したところ,SIDT13YXXΦはリソソーム局在を示した.さらにパルスチェイス実験の結果,SIDT13YXXΦの過剰発現は細胞内RNA分解を,野生型SIDT2過剰発現と同程度亢進させた21).これらの結果からSIDT2の三つのYXXΦモチーフが機能的であることが確認された.また,野生型SIDT1であってもリソソームに移行するような細胞や環境が存在すれば,RDAにおいて機能すると推測される.
RDAに関しては,発見から6年ほど経過したものの,メカニズムにおいても生理作用においてもまだ不明なことが多く残されている.現在,一つ一つ解決していこうと研究中である.特定のタンパク質を基質とするCMAについても,はっきりとしたトランスポーターは報告されていない.さらに,マルチモードオートファジーのなかには,まだ発見されていない経路も残されていると考えられる.これからも,膜透過型オートファジーも含めて未知の分野の開拓に挑んでいきたい.また,得られた知見に基づいて,関連する疾患の病態解明研究や疾患治療への応用も進めていきたいと考えている.
引用文献References
1) Fujiwara, Y., Wada, K., & Kabuta, T. (2017) Lysosomal degradation of intracellular nucleic acids-multiple autophagic pathways. J. Biochem., 161, 145–154.
2) Klionsky, D.J., Abdelmohsen, K., Abe, A., Abedin, M.J., Abeliovich, H., Acevedo Arozena, A., Adachi, H., Adams, C.M., Adams, P.D., Adeli, K., et al. (2016) Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy, 12, 1–222.
3) 株田智弘,藤原悠紀,和田圭司(2013)リソソームは小胞輸送を介さずに生体高分子を取り込むか?,生化学,85, 1057–1066.
4) Fujiwara, Y., Furuta, A., Kikuchi, H., Aizawa, S., Hatanaka, Y., Konya, C., Uchida, K., Yoshimura, A., Tamai, Y., Wada, K., et al. (2013) Discovery of a novel type of autophagy targeting RNA. Autophagy, 9, 403–409.
5) Fujiwara, Y., Kikuchi, H., Aizawa, S., Furuta, A., Hatanaka, Y., Konya, C., Uchida, K., Wada, K., & Kabuta, T. (2013) Direct uptake and degradation of DNA by lysosomes. Autophagy, 9, 1167–1171.
6) Eskelinen, E.L., Cuervo, A.M., Taylor, M.R., Nishino, I., Blum, J.S., Dice, J.F., Sandoval, I.V., Lippincott-Schwartz, J., August, J.T., & Saftig, P. (2005) Unifying nomenclature for the isoforms of the lysosomal membrane protein LAMP-2. Traffic, 6, 1058–1061.
7) Cuervo, A.M. & Dice, J.F. (1996) A receptor for the selective uptake and degradation of proteins by lysosomes. Science, 273, 501–503.
8) Weiss, M.A. & Narayana, N. (1998) RNA recognition by arginine-rich peptide motifs. Biopolymers, 48, 167–180.
9) Tan, R. & Frankel, A.D. (1995) Structural variety of arginine-rich RNA-binding peptides. Proc. Natl. Acad. Sci. USA, 92, 5282–5286.
10) Fujiwara, Y., Hase, K., Wada, K., & Kabuta, T. (2015) An RNautophagy/DNautophagy receptor, LAMP2C, possesses an arginine-rich motif that mediates RNA/DNA-binding. Biochem. Biophys. Res. Commun., 460, 281–286.
11) Hase, K., Fujiwara, Y., Kikuchi, H., Aizawa, S., Hakuno, F., Takahashi, S., Wada, K., & Kabuta, T. (2015) RNautophagy/DNautophagy possesses selectivity for RNA/DNA substrates. Nucleic Acids Res., 43, 6439–6449.
12) Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K., & Walter, P.(2008) Molecular Biology of the Cell, 5th edition, Garland Science, New York.
13) Winston, W.M., Molodowitch, C., & Hunter, C.P. (2002) Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science, 295, 2456–2459.
14) Feinberg, E.H. & Hunter, C.P. (2003) Transport of dsRNA into cells by the transmembrane protein SID-1. Science, 301, 1545–1547.
15) Shih, J.D. & Hunter, C.P. (2011) SID-1 is a dsRNA-selective dsRNA-gated channel. RNA, 17, 1057–1065.
16) Schroder, B., Wrocklage, C., Pan, C., Jager, R., Kosters, B., Schafer, H., Elsasser, H.P., Mann, M., & Hasilik, A. (2007) Integral and associated lysosomal membrane proteins. Traffic, 8, 1676–1686.
17) Jialin, G., Xuefan, G., & Huiwen, Z. (2010) SID1 transmembrane family, member 2 (Sidt2): a novel lysosomal membrane protein. Biochem. Biophys. Res. Commun., 402, 588–594.
18) Chapel, A., Kieffer-Jaquinod, S., Sagne, C., Verdon, Q., Ivaldi, C., Mellal, M., Thirion, J., Jadot, M., Bruley, C., Garin, J., et al. (2013) An extended proteome map of the lysosomal membrane reveals novel potential transporters. Mol. Cell. Proteomics, 12, 1572–1588.
19) Aizawa, S., Fujiwara, Y., Contu, V.R., Hase, K., Takahashi, M., Kikuchi, H., Kabuta, C., Wada, K., & Kabuta, T. (2016) Lysosomal putative RNA transporter SIDT2 mediates direct uptake of RNA by lysosomes. Autophagy, 12, 565–578.
20) Aizawa, S., Contu, V.R., Fujiwara, Y., Hase, K., Kikuchi, H., Kabuta, C., Wada, K., & Kabuta, T. (2017) Lysosomal membrane protein SIDT2 mediates the direct uptake of DNA by lysosomes. Autophagy, 13, 218–222.
21) Contu, V.R., Hase, K., Kozuka-Hata, H., Oyama, M., Fujiwara, Y., Kabuta, C., Takahashi, M., Hakuno, F., Takahashi, S.I., Wada, K., et al. (2017) Lysosomal targeting of SIDT2 via multiple YxxΦ motifs is required for SIDT2 function in the process of RNautophagy. J. Cell Sci., 130, 2843–2853.
著者紹介Author Profile
 株田 智弘(かぶた ともひろ)
株田 智弘(かぶた ともひろ)国立精神・神経医療研究センター神経研究所疾病研究第四部第一研究室長.博士(農学).
略歴神奈川県出身.1999年東京大学農学部卒業.2004年同大学院農学生命科学研究科博士課程修了.同年同研究科ポスドク,04~10年国立精神・神経センター神経研究所ポスドク.10年3月より現職(同年4月独法化).
研究テーマと抱負細胞内分解機序と神経変性疾患の病態機序の解明.私達が発見した新規オートファジーのメカニズムと生理・病態生理的意義の解明を含め,リソソームの知られざる機能や未知の生命現象を可能な限り解明していきたい.
ウェブサイトhttps://www.ncnp.go.jp/nin/guide/r4/staff/kabuta.html
趣味ドラム,ベース,ライブ参戦,DTM,音楽を聴くこと(激しめを含む).
 Contu Viorica Raluca(Contu Viorica Raluca)
Contu Viorica Raluca(Contu Viorica Raluca)国立精神・神経医療研究センター神経研究所疾病研究第四部外来研究員(JSPS外国人特別研究員).博士(医学).
略歴利根川進博士のノーベル賞受賞年にルーマニアに生る.2012年広島大学薬学部薬科学科卒業.14年同大学院医歯薬保健学研究科博士課程前期修了.18年山梨大学大学院医学工学総合教育部博士課程修了.15~18年JSPS特別研究員(DC-1).18年4月国立精神・神経医療研究センター流動研究員.11月より現職.
研究テーマと抱負RNautophagy/DNautophagyの分子メカニズムの解明を目指して研究を行っています.生命科学におけるリソソームによる核酸分解の重要性を位置付けたいとともに現代人のためにもなる研究ができると一番嬉しいです.
趣味旅,ラテン音楽,できないと思い込んでいることに挑戦すること.