1)ミクロオートファジーの膜動態
1966年,Christian de Duveらは,細胞質の構成成分をリソソームへと輸送して分解する過程をオートファジーと名づけた.同時に,その様式には,オートファゴソーム形成の後,リソソームと融合する「マクロオートファジー」と,細胞質の“小さな”部分がリソソームにより直接囲まれて内部へと取り込まれる「ミクロオートファジー」があることを記載している1).さらに,その形態学的研究から,肝細胞やマクロファージ由来の動物細胞の他,酵母,植物においても,ミクロオートファジーを示すリソソーム(または液胞)の形態変化が観察されている2–4).
ミクロオートファジーについては,1990年代後半にメタノール資化性酵母Komagataella phaffii(旧名Pichia pastoris)におけるペルオキシソーム分解5, 6)が,近年になってようやく酵母Saccharomyces cerevisiaeにおける脂肪滴(lipid droplet:LD)分解7)が,ミクロオートファジーにより起こることが見いだされ,それに関わる分子としてAtg分子群やESCRT(endosomal sorting complex required for transport complex)分子群が知られるようになってきた.筆者らは,ミクロペキソファジーにおけるAtg分子群の必要性からミクロオートファジー時に形成される膜構造体(micropexophagic membrane apparatus:MIPA)を発見した8).両ミクロオートファジーにおける共通性を見いだそうとして,2種の酵母を対象としたが,これらのミクロオートファジーの分子機構には大きな違いがあり,ミクロリポファジーの分子機構に関しては,現在,Atg分子群の要求性・非要求性について大きな論争がある.このようにミクロオートファジーは,広く真核細胞に見いだされていたにもかかわらず,ATG分子群を核としたマクロオートファジーの分子機構解明とは対照的に,不明かつ混沌としているのが現状である.
2)ミクロオートファジーの分類:Type 1~Type 3
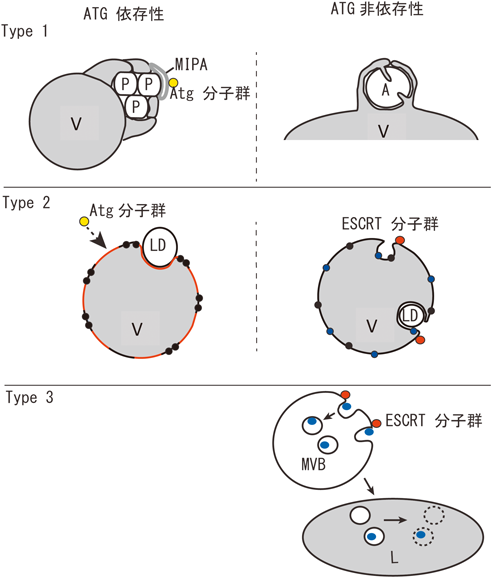
筆者らは,ミクロオートファジーの包括的な理解を困難にしている要因が,ミクロオートファジーの多様性と複雑性が認知されてこなかったことによると考え,ミクロオートファジーをType 1~Type 3の三つのカテゴリーに分ける新規分類法を提示し,これらの多様性を理解した上で分子機構を探索する戦略を提唱している9).
ミクロオートファジーの観察像を大別すると,1)リソソームや液胞の一部分が腕を伸ばすような形に伸長しているもの,そして伸長した先端の部分がリソソーム本体と再び近接・接触しているもの(図1, Type 1),2)リソソーム全体が扁平状の構造に変化して湾曲し,その先端部分どうしが接して細胞質成分を内部に隔離するもの(図1, Type 2)がある.また,3)リソソームまたは液胞などの分解コンパートメントの膜ではなく,エンドソーム膜の陥入によるミクロオートファジー(エンドソーム・ミクロオートファジー)が哺乳類細胞10),さらに分裂酵母11)においても報告された(図1, Type 3).この過程はエンドソームにおける多胞体(multivesicular body:MVB)形成機構を用いた細胞質成分の取り込みで,MVB経路との相違点は,分解対象が,細胞外成分や細胞膜成分ではなく細胞質成分であることにある.本稿では,このような分類に従い,明らかになりつつあるミクロオートファジーの分子機構について概説する.
2. 酵母K. phaffiiにおけるミクロペキソファジー(Type 1)の分子機構
1)ミクロペキソファジーの液胞動態と欠損株の単離
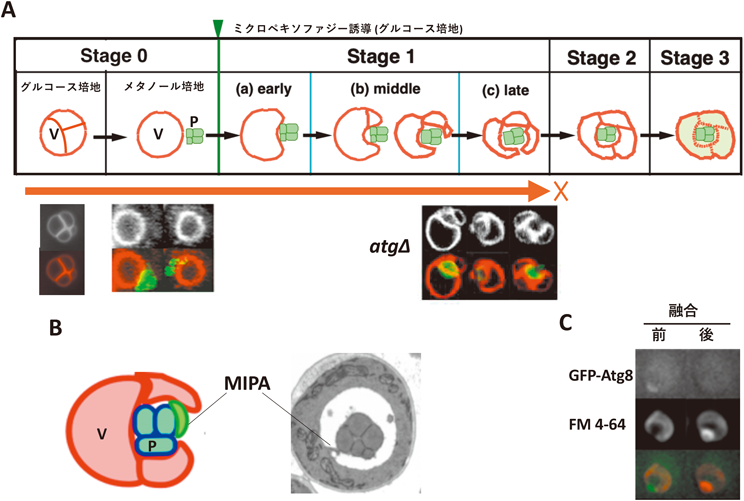
異種遺伝子発現宿主としても汎用されるK. phaffiiは,メタノールを炭素源とした培地で生育させると,メタノール代謝酵素を持つ巨大なペルオキシソームを発達させる.このことから,ペルオキシソーム動態研究に利用され,多数のペルオキシン(PEX)遺伝子の同定に役立った.ペルオキシソームの発達した酵母を,グルコースあるいはエタノールを炭素源とした培地にシフトするとメタノール代謝が不要になり,ペルオキシソームが,ミクロオートファジーもしくはマクロオートファジーにより分解される5, 6).1996~1997年,筆者はSubramani研(UCSD)に在籍してペルオキシソーム生合成研究を目的に脂質代謝を追跡するため,さまざまな脂質蛍光標識を検討していた.その過程で,ペルオキシソームをGFP-SKL,液胞膜をFM 4-64でラベルし,エタノール培地へシフトするとGFP-SKLが液胞内腔に拡散した5).現在,酵母オートファジー研究においてはGFP-プロセッシングアッセイが汎用される12)が,当時,プロテアーゼを多く含む液胞に輸送されたGFPは速やかに分解されると考えられていたので予想外の発見であった.メタノール培養時,本酵母は一つの大きな丸い液胞を持つが,培地シフト後,液胞に大きな形の変化はない.一方,グルコース培地にシフトすると,液胞が分節化(septation)し,液胞隔離膜(vacuolar sequestering membrane:VSM)を形成しながら伸長し13),ペルオキシソームを取り囲んでいくようすが観察された.これをもとにミクロペキソファジーの素過程をStage 0からStage 3に解剖したモデルを立てた(図2A).
このような形態観察の一方で,変異株ライブラリーを作製し,ミクロオートファジー誘導条件にシフトした後,ペルオキシソーム酵素アルコールオキシダーゼ(Aox)の酵素活性をコロニー染色し,Aox活性が残存する変異株を取得し,変異株染色体から変異ベクター挿入周辺部位を回収することによりミクロオートファジーに関与する遺伝子を単離した13).当時,pexophagy deficient among zeocin resistantとしてpaz変異株/PAZ遺伝子と名づけたが,後にATG遺伝子として統合された14).
得られた変異株について,ミクロオートファジーのどのStageでミクロオートファジーが終結するか,その表現型を明らかにし,変異原遺伝子との関連を調べた.その結果,現在,ATG遺伝子として知られる多くの遺伝子の変異株では,ペルオキシソームを液胞が囲い込む寸前のStage 1cでミクロペキソファジーが終結していた(図2B)13).
2)Atg分子群により駆動されるMIPAの形成とその機能
Stage 1cで多くのatg変異株が停止することがわかったので,オートファゴソームと同様,何らかの膜構造体が液胞膜の閉じ込みに関係するのかと考え,オートファゴソームマーカーGFP-Atg8発現株を用いてミクロペキソファジーを追跡した.すると,ペルオキシソームを取り囲んで伸長する液胞の先端部分をつなぐ部分にGFP-Atg8がカップ状に局在した8)(図2B).免疫電子顕微鏡と蛍光顕微鏡を用いたタイムラプス解析により,このカップ状の構造体が液胞膜と融合して閉じ込むことが明らかとなり(図2C),これをMIPAと名づけた8).以前の電子顕微鏡写真5)から,液胞閉じ込みの後,MIPAが液胞内に取り込まれていることもわかる(図2B).MIPAは液胞の最終段階での融合を介在しAtg8が局在するカップ状構造体で,atg変異株ではMIPAができないために液胞伸長先端部での膜融合ができないと考えられる.このように,ATG分子は,ミクロペキソファジー過程で必要なMIPAの形成に機能する8).
3)液胞形態制御における脂質化に依存しないAtg8の機能
多くのAtg分子群が,MIPA形成に関わっていたものの,すべてのAtg分子の機能がMIPA形成のみで説明できるというわけではない.大部分のatg変異株は,メタノール誘導すると大きく丸い一つの液胞を野生株と同様に持ち,ミクロペキソファジーは,Stage 1cで終結する(図2A).その一方,atg8∆株においては,ペルオキシソーム誘導時(ミクロペキソファジーを誘導前),すでに液胞が異常な形態を示した15).そこで,K. phaffiiにおける液胞の形態制御について,Atg8の分子機能から探ることにした.
ペルオキシソームの誘導条件下では,atg8∆株の液胞形態が異常で,解析が困難なので,よりマイルドな液胞融合条件下で観察した.ペルオキシソームを誘導しないグルコース培地では液胞は3~4個のコンパートメントを持つが,メタノール培地に移すと30~40分ぐらいで液胞どうしが融合し,一つの大きな液胞になる(図2A).
オートファジーの過程でユビキチン様タンパク質であるAtg8は,Atg4によるC末端アミノ酸切断により露出したグリシン残基が,E1酵素Atg7,E2酵素Atg3による活性化の後,ホスホエタノールアミン(PE)化修飾を受け,オートファゴソームに局在する16, 17).またリポソーム膜にアンカーされたAtg8-PEが,リポソームどうしの繋留(tethering)ならびに半融合(hemifusion)活性を持つことが報告された18).atg1∆株では野生株と同じように液胞融合が観察されたが,atg8∆株では液胞融合がみられず,液胞融合はオートファジーに依存しない15).
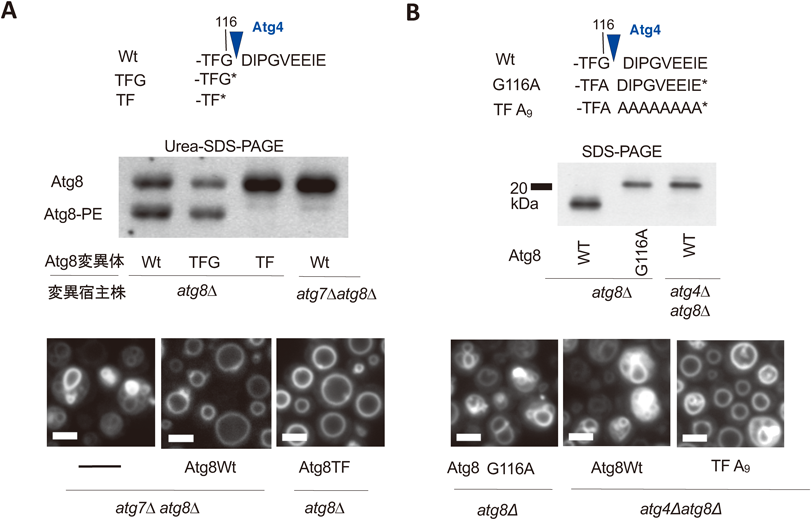
さまざまなAtg8変異体をatg8∆株に導入し,液胞形態の相補活性を調べた(図3).リポソームの半融合活性に必要なAtg8アミノ酸残基の変異により相補活性が失われたことから,液胞融合にはAtg8の触媒活性が必要であった.S. cerevisiaeにおいては,Atg4により切断されるペプチドはArg 1残基のみであるが19),K. phaffii Atg8(KpAtg8)は9アミノ酸からなるペプチドである(図3A).驚いたことに,Atg4による切断後に露出され,脂質化に必要なGly残基を欠失させたAtg8 TFが,野生型Atg8と同様に液胞形態を相補した(図3A).さらなる生化学的な検証により,液胞形態制御にAtg8の脂質化は必要なかった15).
一方,Atg4による切断を受けず,C末端ペプチドが切断されないAtg8 G116Aは,液胞融合活性を相補できない(図3B).一方,C末端ペプチド配列の代わりに,Ala反復配列を持つAtg8 TF A9は,部分的ではあるが液胞融合活性を相補した(図3B).さらに,Atg8への結合活性が知られているWEELモチーフ20)にKpAtg8 C末端ペプチド配列は類似しており,推定立体構造から,C末端ペプチドがプロ配列のように触媒領域を塞いで触媒活性を阻害していることが予想された.このようなAtg8のC末端配列は,他のメタノール資化性酵母,植物病原菌でも保存されている15).
4)MIPA形成と液胞形態制御のバランス
ミクロペキソファジーにおいて,Atg8は,MIPAの形成と同時に,液胞の形態制御にも関与するするので,これら二つの機能がバランスよく制御される必要がある.最近,K. phaffiiにおいて,ユビキチン様タンパク質であるAtg1221)にはAtg5との共役結合に必要なC末端Gly残基がないこと,本酵母では,Atg12–Atg5は共有結合ではなく非共有結合による複合体として存在しAtg12–Atg5複合体がオートファジーに必要なこと,Atg12–Atg5共有結合の形成を触媒するE2酵素Atg10をコードする遺伝子がゲノム上にないことが明らかとなった22).Atg12–Atg5共役系は,Atg8-PE化反応におけるE3酵素として働く23)ので,Atg12–Atg5の共有結合から非共有結合への退縮進化は,ミクロペキソファジーにおけるAtg8の二つの機能(MIPA形成と液胞形態)の制御をよりフレキシブルに行うためのものかもしれない.
Atg8以外にも,液胞の形態制御に関わる分子として,筆者らはAtg18ならびにVac8を見いだしている.KpAtg18がホスファチジルイノシトール3,5-ビスリン酸[PI(3,5)P2]に強い結合能を持つこと,Atg18がリン酸化を受けることを見いだし,そのAtg18のリン酸化が,PI(3,5)P2結合能を負に制御し,液胞形態を制御していた24).またVac8は脂質化により液胞膜にアンカーされるタンパク質で,細胞分裂時の母細胞から娘細胞への液胞の継承(inheritance)に機能するタンパク質として同定されたもので,ミクロペキソファジーにおいては,液胞形態とMIPAの形成は,これらの分子により厳密な制御を受けていると考えられる25, 26).
3. パン酵母S. cerevisiaeにおけるミクロリポファジー(Type 2)
1)分子機構解析とその問題点
S. cerevisiaeにおけるミクロオートファジーについては古くから記載され,近年,LDがミクロリポファジーにより分解されることがわかり,それに関わる分子の報告が相次いでいる.しかし研究グループによりその結果が著しく異なっており,中心的Atg分子の要求性についても,1)ほぼすべて必要だとするもの7, 27),2)一部のみ必要とするもの28),3)Atg15分子以外は不要であるとするもの9, 29)など,ミクロリポファジーの分子機構については不明というより,少々,混乱状態にある.
筆者は,ミクロリポファジー研究を進める中で,このような混乱を引き起こす実験的な要因が少なくとも二つあると考えている.一つ目は,GFP-プロセッシングアッセイに用いるLD局在タンパク質の特性である.これらは,LDのみならず,小胞体にも局在する(図4D参照).さらに,他のオルガネラと異なってLDには内腔がなく,LD-マーカータンパク質は,すべて膜表在性タンパク質である.顕微鏡下,一見,LDに局在するようにみえていても,人為的な発現により足場となるLD量に比して発現タンパク質が多いと,マーカータンパク質がLDからサイトゾルに遊離し,Atg分子依存的なマクロオートファジーにより分解されてしまうことになる.しかもリポファジー誘導に窒素源欠乏培地や,長時間培養など,栄養飢餓となる条件が用いられており,ミクロリポファジー誘導条件では,マクロオートファジーが同時に誘導されている可能性も否定できない.
もう一つの要因は,S. cerevisiae株の違いによると思われる.我々は,S. cerevisiae W303株においてミクロオートファジーによる液胞膜タンパク質分解が,YPD(富栄養培地)培養定常期後期(16~24 h)に起こることを見いだし(図4A, B),これを解析に用いた.しかし,同様の培養条件で,遺伝子破壊ライブラリーが整備されているS. cerevisiae BY4742株を用いるとこの結果は再現できず,ミクロリポファジー誘導のためには3日の培養が必要で,この時点では栄養源飢餓によるオートファジーも起こっている可能性がある.
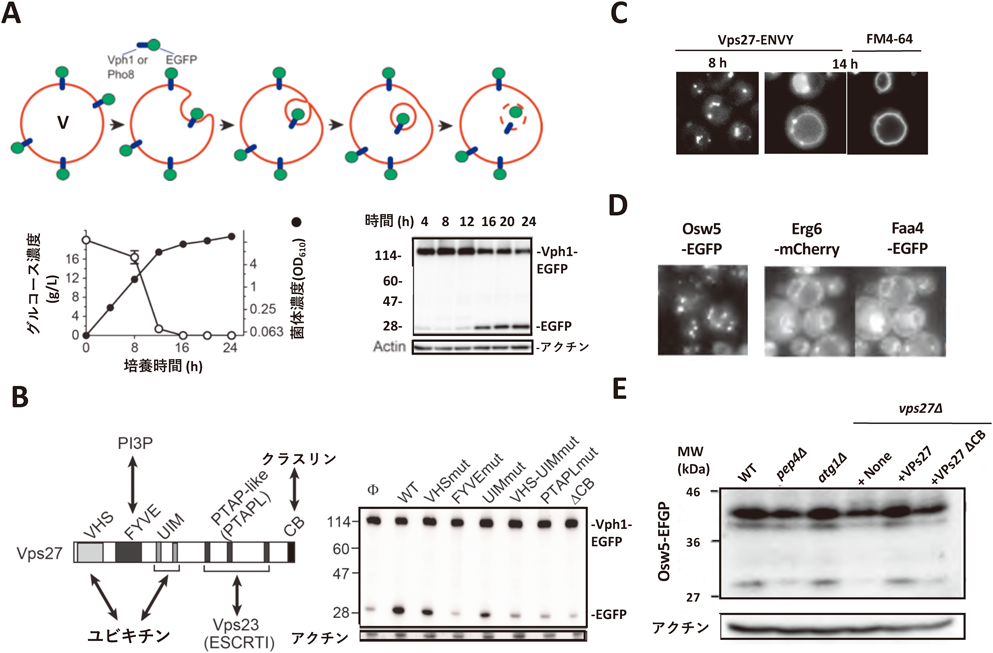
筆者らは,S. cerevisiae W303株の方が,マクロオートファジーの影響を受けにくく,より直接的にミクロリポファジーの分子機構を解析できると考え,ミクロオートファジーとLD分解を二つのレポータータンパク質で解析した.ミクロオートファジーマーカーとして液胞膜タンパク質であるVph1-EGFPとEGFP-Pho8,LD分解マーカーとして,推定疎水性ヘアピン構造領域30)を持ち小胞体への局在が観察されないOsw5-EGFPを新たに用いた.液胞膜タンパク質とLDタンパク質はミクロオートファジーにより液胞内に取り込まれると,それぞれ分解を受けるが,融合タンパク質のGFP部分はプロテアーゼに対して比較的耐性を示すためGFP-プロセッシングアッセイが可能となる12).
2)ESCRTとクラスリンのミクロオートファジーへの関与
S. cerevisiae W303株をYPD培地で16~24 h培養すると,液胞膜タンパク質の分解と,ミクロリポファジーを示す電子顕微鏡像が観察された31).この時間帯でのVph1-EGFPのプロセッシングを指標にコアのATG遺伝子破壊株(atg1∆~atg18∆)他,さまざまな遺伝子破壊株をスクリーニングしたところ,ほとんどのAtg分子は液胞膜タンパク質の分解には関与しないことがわかった.この他,過去にミクロオートファジーに関わることが報告されていた各種遺伝子を試してみたところ,多くのESCRT分子群(ESCRT 0, -1, -2, -3, Doa4を含む)が,Vph1-EGFPの分解に必要であった.
ESCRT分子は,細胞膜タンパク質が,エンドサイトーシスの後,液胞に取り込まれ分解されるMVB経路に必要な分子として同定されている32).解析当時,液胞膜タンパク質の分解についてはあまり知られていなかったが,液胞膜タンパク質が,一度,液胞膜から出て後期エンドソームに輸送された後,再びMVB経路で,液胞に取り込まれるというモデルも提唱されていた33).MVB経路の途中では,エンドソームがESCRT分子群の作用によりエンドソームが湾曲して小胞を形成する.また膜上でのESCRTタンパク質複合体の形成はin vitroでも膜の陥入を引き起こす34).次に,ESCRT分子群が直接,陥入や融合など,液胞の形態を制御しているのではないかと考え,Vps27を中心に解析を進めることにした.
Vps27は,広く哺乳類にもHrsとして保存され,MVB形成初期に働くESCRT-0タンパク質であり,二つのユビキチン結合ドメイン,PI結合性FYVEドメイン,ESCRT-I Vps23との相互作用ドメイン,クラスリン重鎖結合ドメイン(CB)を持つ(図4B)35–37).各ドメインのうち,CBを除くドメインは,MVB経路とVph1-EGFPの分解の両者に必須であった.CBはMVB経路に大きな寄与はない38)が,Vph1-EGFP分解にはCBドメインが必要であった(図4B).さらにクラスリン温度感受性変異株chc1-5株では,Vph1-EGFPの分解活性は減退していた.蛍光タンパク質Envyを用いてEnvy-Vps27の細胞内局在を観察したところ,Vph1-EGFPの分解が観察されない増殖期においてはエンドソーム上に局在していたが,ミクロオートファジーの観察される,16~24 hになると,Envy-Vps27は液胞膜上にその局在を移行させていることがわかった(図4C).
以上の実験から,Vph1-EGFP分解時には,Vps27はその局在をエンドソームから液胞に変化させ,ESCRTがエンドソームでなく液胞,クラスリンとの相互作用により,液胞膜上のタンパク質であるVph1やPho8を液胞の陥入により液胞内に取り込んで,ミクロオートファジーにより分解していることが強く示唆された31).
これまで,GFP-プロセッシングアッセイに用いられてきたLD局在タンパク質Faa4やErg67)は,元来,LDが小胞体から出芽形成されるオルガネラであることもあり,LDと小胞体の両方に局在する(図4D).そこで,新たに忠実なLDマーカーとして我々が見いだしたOsw5-EGFPを用いてLD分解を追跡した31).その結果,Vph1-EGFP分解の結果と同様,vps27∆株,Vps27ΔCB株,pep4∆株でOsw5-EGFPの分解は阻害されたが,atg1∆株での阻害はみられなかった(図4E).以上の生化学・形態学の結果は,S. cerevisiaeでは,ESCRTがミクロリポファジーに必要なことを強く示唆している.
最近,ESCRTタンパク質がマクロオートファジーにおけるオートファゴソームの閉じ込みに必要なことも報告され39),ミクロオートファジー時においてESCRTは,液胞の陥入または閉じ込み,あるいは両方で機能していると考えられる.
3)ミクロリポファジーと液胞上の膜ドメイン形成
S. cerevisiaeでは,栄養飢餓時,液胞膜の陥入がチューブ状になり,ミクロオートファジーが起こることが知られている40).この陥入部位は他の部分と異なり膜貫通タンパク質をほとんど含まないことから,液胞膜に局所領域(ドメイン)形成が起きていると考えられている.また最近の研究から,酵母におけるミクロリポファジーにおいては,液胞に局在するステロール輸送タンパク質Ncr1とNpc2が液胞膜上ドメイン構造の形成に機能し,液胞膜の陥入を引き起こす駆動力となりうることが報告された41).核の一部を取り込むミクロオートファジーにおいても,核と液胞の接触部位がドメイン構造をとることがわかっているが42),どのような分子機構でドメインができるのか,またドメイン形成が液胞膜の変形にどう寄与するのかという問いに対する答えはまだ得られていない.
4. エンドソーム・ミクロオートファジー(Type 3)
エンドソーム・ミクロオートファジーは哺乳類細胞10)や分裂酵母11)で見いだされ,さらにショウジョウバエを対象とした研究43)により,シナプス近傍での神経細胞内タンパク質分解に重要であることが明らかになるなど,その研究が急速に進展している.
エンドソームにおけるMVB形成は,従来は受容体や輸送体など,膜タンパク質を分解する経路として理解されてきた.しかしMVB形成時の膜陥入に伴い,細胞質タンパク質がエンドソーム内腔に取り込まれることが明らかとなった10).取り込まれたタンパク質はエンドソームにおいて一部分解され,さらにエンドソームがリソソームと融合することで取り込まれたタンパク質がリソソーム酵素群により分解される.この過程は細胞質成分をリソソームに輸送し分解する機構であり,膜の陥入を経ることからエンドソーム・ミクロオートファジーと命名された.
その過程における顕著な特徴は選択的なタンパク質分解である10).この選択性はエンドソーム膜上に移行するHSC70タンパク質を介してもたらされる.HSC70は標的タンパク質内のKFERQ様配列と呼ばれる部分を認識するため,この配列を持つタンパク質が優先的にMVB内部に引き込まれる.代表的な例として,解糖系酵素群[グリセルアルデヒド-3-リン酸脱水素酵素(GAPDH)やアルドラーゼ]が知られている.
エンドソーム・ミクロオートファジーにおける膜の陥入はMVB形成の機構と分子を利用しており,ESCRTタンパク質により行われている.一方,ショウジョウバエを用いた最近の研究から,Hsc70タンパク質自身も膜を変形させる能力を持つことが報告された43).Hsc70はシャペロンタンパク質としての機能(タンパク質立体構造形成を補助する機能)も持つが,膜の変形にはHsc70のシャペロンとしての機能は必要ない.一方で,Hsc70の持つ膜移行性は膜変形能に重要であり,Hsc70自身のオリゴマー形成能と膜変形能との間にも高い相関性がみられた.
興味深いことに,ショウジョウバエのシナプスを形成する神経細胞部位ではKFERQ様配列を持つ複数のタンパク質(Unc-13, EndoA, WASp, Comt/NSF)がHsc70によるエンドソーム・ミクロオートファジーを経て分解され,量制御を受けていた43).さらに,ミクロオートファジーの機能を欠いたHsc70を発現させた細胞が形成するシナプスでは,神経伝達物質の放出能が低下したことから,エンドソーム・ミクロオートファジーが神経機能を制御していることも示された.
シャペロン介在性オートファジー(CMA)が,哺乳類細胞に古くから見いだされている44)が,CMAにも,KFERQ様配列とHSC70は必要で,分解対象となるタンパク質もエンドソーム・ミクロオートファジーとCMAでは重複しており,CMAの実体が,エンドソーム・ミクロオートファジーである可能性がある.
この他,ATG分子群が関与するという報告も多数あるが,上述のように用いたLDレポータータンパク質やミクロオートファジー誘導条件の問題があり,さらなる今後の検証が必要である.
引用文献References
1) De Duve, C. & Wattiaux, R. (1966) Functions of lysosomes. Annu. Rev. Physiol., 28, 435–492.
2) Moeller, C.H. & Thomson, W.W. (1979) Uptake of lipid bodies by the yeast vacuole involving areas of the tonoplast depleted of intramembranous particles. J. Ultrastruct. Res., 68, 38–45.
3) Mijaljica, D., Prescott, M., & Devenish, R.J. (2011) Microautophagy in mammalian cells: revisiting a 40-year-old conundrum. Autophagy, 7, 673–682.
4) Chanoca, A., Kovinich, N., Burkel, B., Stecha, S., Bohorquez-Restrepo, A., Ueda, T., Eliceiri, K.W., Grotewold, E., & Otegui, M.S. (2015) Anthocyanin vacuolar inclusions form by a microautophagy mechanism. Plant Cell, 27, 2545–2559.
5) Sakai, Y., Koller, A., Rangell, L.K., Keller, G.A., & Subramani, S. (1998) Peroxisome degradation by microautophagy in Pichia pastoris: identification of specific steps and morphological intermediates. J. Cell Biol., 141, 625–636.
6) Tuttle, D.L. & Dunn, W.A. Jr. (1995) Divergent modes of autophagy in the methylotrophic yeast Pichia pastoris. J. Cell Sci., 108, 25–35.
7) van Zutphen, T., Todde, V., de Boer, R., Kreim, M., Hofbauer, H.F., Wolinski, H., Veenhuis, M., van der Klei, I.J., & Kohlwein, S.D. (2014) Lipid droplet autophagy in the yeast Saccharomyces cerevisiae. Mol. Biol. Cell, 25, 290–301.
8) Mukaiyama, H., Baba, M., Osumi, M., Aoyagi, S., Kato, N., Ohsumi, Y., & Sakai, Y. (2004) Modification of a ubiquitin-like protein Paz2 conducted micropexophagy through formation of a novel membrane structure. Mol. Biol. Cell, 15, 58–70.
9) Oku, M. & Sakai, Y. (2018) Three distinct types of microautophagy based on membrane dynamics and molecular machineries. BioEssays, 40, e1800008.
10) Sahu, R., Kaushik, S., Clement, C.C., Cannizzo, E.S., Scharf, B., Follenzi, A., Potolicchio, I., Nieves, E., Cuervo, A.M., & Santambrogio, L. (2011) Microautophagy of cytosolic proteins by late endosomes. Dev. Cell, 20, 131–139.
11) Liu, X.M., Sun, L.L., Hu, W., Ding, Y.H., Dong, M.Q., & Du, L.L. (2015) ESCRTs cooperate with a selective autophagy receptor to mediate vacuolar targeting of soluble cargos. Mol. Cell, 59, 1035–1042.
12) Cheong, H. & Klionsky, D.J. (2008) Biochemical methods to monitor autophagy-related processes in yeast. Methods Enzymol., 451, 1–26.
13) Mukaiyama, H., Oku, M., Baba, M., Samizo, T., Hammond, A.T., Glick, B.S., Kato, N., & Sakai, Y. (2002) Paz2 and 13 other PAZ gene products regulate vacuolar engulfment of peroxisomes during micropexophagy. Genes Cells, 7, 75–90.
14) Klionsky, D.J., Cregg, J.M., Dunn, W.A. Jr., Emr, S.D., Sakai, Y., Sandoval, I.V., Sibirny, A., Subramani, S., Thumm, M., Veenhuis, M., et al. (2003) A unified nomenclature for yeast autophagy-related genes. Dev. Cell, 5, 539–545.
15) Tamura, N., Oku, M., & Sakai, Y. (2010) Atg8 regulates vacuolar membrane dynamics in a lipidation-independent manner in Pichia pastoris. J. Cell Sci., 123, 4107–4116.
16) Kirisako, T., Baba, M., Ishihara, N., Miyazawa, K., Ohsumi, M., Yoshimori, T., Noda, T., & Ohsumi, Y. (1999) Formation process of autophagosome is traced with Apg8/Aut7p in yeast. J. Cell Biol., 147, 435–446.
17) Ichimura, Y., Kirisako, T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., et al. (2000) A ubiquitin-like system mediates protein lipidation. Nature, 408, 488–492.
18) Nakatogawa, H., Ichimura, Y., & Ohsumi, Y. (2007) Atg8, a ubiquitin-like protein required for autophagosome formation, mediates membrane tethering and hemifusion. Cell, 130, 165–178.
19) Kirisako, T., Ichimura, Y., Okada, H., Kabeya, Y., Mizushima, N., Yoshimori, T., Ohsumi, M., Takao, T., Noda, T., & Ohsumi, Y. (2000) The reversible modification regulates the membrane-binding state of Apg8/Aut7 essential for autophagy and the cytoplasm to vacuole targeting pathway. J. Cell Biol., 151, 263–276.
20) Noda, N.N., Ohsumi, Y., & Inagaki, F. (2010) Atg8-family interacting motif crucial for selective autophagy. FEBS Lett., 584, 1379–1385.
21) Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M., & Ohsumi, Y. (1998) A protein conjugation system essential for autophagy. Nature, 395, 395–398.
22) Pang, Y., Yamamoto, H., Sakamoto, H., Oku, M., Mutungi, J.K., Sahani, M.H., Kurikawa, Y., Kita, K., Noda, N.N., Sakai, Y., et al. (2019) Evolution from covalent conjugation to non-covalent interaction in the ubiquitin-like ATG12 system. Nat. Struct. Mol. Biol., 26, 289–296.
23) Hanada, T., Noda, N.N., Satomi, Y., Ichimura, Y., Fujioka, Y., Takao, T., Inagaki, F., & Ohsumi, Y. (2007) The Atg12–Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy. J. Biol. Chem., 282, 37298–37302.
24) Tamura, N., Oku, M., Ito, M., Noda, N.N., Inagaki, F., & Sakai, Y. (2013) Atg18 phosphoregulation controls organellar dynamics by modulating its phosphoinositide-binding activity. J. Cell Biol., 202, 685–698.
25) Wang, Y.X., Catlett, N.L., & Weisman, L.S. (1998) Vac8p, a vacuolar protein with armadillo repeats, functions in both vacuole inheritance and protein targeting from the cytoplasm to vacuole. J. Cell Biol., 140, 1063–1074.
26) Oku, M., Nishimura, T., Hattori, T., Ano, Y., Yamashita, S., & Sakai, Y. (2006) Role of Vac8 in formation of the vacuolar sequestering membrane during micropexophagy. Autophagy, 2, 272–279.
27) Wang, C.W., Miao, Y.H., & Chang, Y.S. (2014) A sterol-enriched vacuolar microdomain mediates stationary phase lipophagy in budding yeast. J. Cell Biol., 206, 357–366.
28) Seo, A.Y., Lau, P.W., Feliciano, D., Sengupta, P., Gros, M.A.L., Cinquin, B., Larabell, C.A., & Lippincott-Schwartz, J. (2017) AMPK and vacuole-associated Atg14p orchestrate mu-lipophagy for energy production and long-term survival under glucose starvation. eLife, 6, e21690.
29) Vevea, J.D., Garcia, E.J., Chan, R.B., Zhou, B., Schultz, M., Di Paolo, G., McCaffery, J.M., & Pon, L.A. (2015) Role for lipid droplet biogenesis and microlipophagy in adaptation to lipid imbalance in yeast. Dev. Cell, 35, 584–599.
30) Bersuker, K. & Olzmann, J.A. (2017) Establishing the lipid droplet proteome: Mechanisms of lipid droplet protein targeting and degradation. Biochim. Biophys. Acta, 1862(10 Pt B), 1166–1177.
31) Oku, M., Maeda, Y., Kagohashi, Y., Kondo, T., Yamada, M., Fujimoto, T., & Sakai, Y. (2017) Evidence for ESCRT- and clathrin-dependent microautophagy. J. Cell Biol., 216, 3263–3274.
32) Henne, W.M., Buchkovich, N.J., & Emr, S.D. (2011) The ESCRT pathway. Dev. Cell, 21, 77–91.
33) Li, M., Rong, Y., Chuang, Y.S., Peng, D., & Emr, S.D. (2015) Ubiquitin-dependent lysosomal membrane protein sorting and degradation. Mol. Cell, 57, 467–478.
34) Saksena, S., Wahlman, J., Teis, D., Johnson, A.E., & Emr, S.D. (2009) Functional reconstitution of ESCRT-III assembly and disassembly. Cell, 136, 97–109.
35) Raiborg, C., Bache, K.G., Mehlum, A., Stang, E., & Stenmark, H. (2001) Hrs recruits clathrin to early endosomes. EMBO J., 20, 5008–5021.
36) Raiborg, C., Bremnes, B., Mehlum, A., Gillooly, D.J., D’Arrigo, A., Stang, E., & Stenmark, H. (2001) FYVE and coiled-coil domains determine the specific localisation of Hrs to early endosomes. J. Cell Sci., 114, 2255–2263.
37) Raiborg, C., Bache, K.G., Gillooly, D.J., Madshus, I.H., Stang, E., & Stenmark, H. (2002) Hrs sorts ubiquitinated proteins into clathrin-coated microdomains of early endosomes. Nat. Cell Biol., 4, 394–398.
38) Bilodeau, P.S., Winistorfer, S.C., Kearney, W.R., Robertson, A.D., & Piper, R.C. (2003) Vps27-Hse1 and ESCRT-I complexes cooperate to increase efficiency of sorting ubiquitinated proteins at the endosome. J. Cell Biol., 163, 237–243.
39) Takahashi, Y., He, H., Tang, Z., Hattori, T., Liu, Y., Young, M.M., Serfass, J.M., Chen, L., Gebru, M., Chen, C., et al. (2018) An autophagy assay reveals the ESCRT-III component CHMP2A as a regulator of phagophore closure. Nat. Commun., 9, 2855.
40) Muller, O., Sattler, T., Flotenmeyer, M., Schwarz, H., Plattner, H., & Mayer, A. (2000) Autophagic tubes: vacuolar invaginations involved in lateral membrane sorting and inverse vesicle budding. J. Cell Biol., 151, 519–528.
41) Tsuji, T., Fujimoto, M., Tatematsu, T., Cheng, J., Orii, M., Takatori, S., & Fujimoto, T. (2017) Niemann-Pick type C proteins promote microautophagy by expanding raft-like membrane domains in the yeast vacuole. eLife, 6, e25960.
42) Dawaliby, R. & Mayer, A. (2010) Microautophagy of the nucleus coincides with a vacuolar diffusion barrier at nuclear-vacuolar junctions. Mol. Biol. Cell, 21, 4173–4183.
43) Uytterhoeven, V., Lauwers, E., Maes, I., Miskiewicz, K., Melo, M.N., Swerts, J., Kuenen, S., Wittocx, R., Corthout, N., Marrink, S.J., et al. (2015) Hsc70-4 deforms membranes to promote synaptic protein turnover by endosomal microautophagy. Neuron, 88, 735–748.
44) Kaushik, S. & Cuervo, A.M. (2012) Chaperone-mediated autophagy: a unique way to enter the lysosome world. Trends Cell Biol., 22, 407–417.