植物は一度大地に根づくと移動することができないため,さまざまな外部環境ストレスから逃れることができず,それらに直接さらされる.そのため,過酷な環境下でも生き延びられるよう,刻々と変化する外部環境をすばやく感知し,それに対し適切に応答する独自の機構を進化させてきている.オートファジーもそれら環境応答機構の一つであり,固着性の生物に特異的な経路や分子機構の存在が推測される.
また,独立栄養生物である植物は,土中から無機栄養素を吸収し,太陽光のエネルギーを最大限利用して化学エネルギーに変換することで無機物から有機物を獲得する.植物は動物とは異なり,無機栄養素だけで生育することが可能である.生育に必須な栄養素(必須元素)は17種類で,窒素(N),リン(P),カリウム(K)の三大要素を筆頭に,カルシウム(Ca),酸素(O),水素(H),炭素(C),マグネシウム(Mg),硫黄(S),鉄(Fe),マンガン(Mn),ホウ素(B),亜鉛(Zn),モリブデン(Mo),銅(Cu),塩素(Cl),ニッケル(Ni)である.どれか一つでも欠けると植物の生長は完結しない.これらのうち,C, H, Oは,光合成で同化される二酸化炭素と,根において吸収される水から得られている.また,これら必須栄養素は植物の要求量が大きい多量要素(C, H, O, N, P, K, Ca, S, Mg:植物組織の乾燥重量の0.2%以上で,多量必須元素ともいう)と小さい微量要素(Fe, Mn, B, Zn, Cu, Mo, Cl, Ni:同0.02%以下で,微量必須元素ともいう)に分類することができる.多量要素はさらに,要求量の違いから多量一次要素(C, H, O, N, P, K)と多量二次要素(Ca, S, Mg)に分けられる.これら無機栄養素の欠乏は(またはその種類によっては),移動することのできない植物に過度なストレスを与える.最近になって,植物がさまざまな無機栄養素の欠乏時に自己成分分解を発動し,ストレス応答していることが明らかになってきている.個々の詳しい分子メカニズムの完全な解明にはまだ至っていないものの,興味深い事実が次々と報告されている.
本稿では,植物栄養学の視点で植物の必須栄養素から植物オートファジーを考えることでみえてくる植物特異的なオートファジーの誘導メカニズムや多彩な経路,そして独立栄養生物がゆえのオートファジーの生理機能を最新のデータとともに紹介する.
酵母や動物と同様に,植物オートファジーの制御は主にラパマイシン標的複合体1(TORC1)シグナル伝達経路を介していると考えられている.シロイヌナズナゲノムには,栄養センシングの中心的なキナーゼタンパク質target of rapamycin(TOR)が一つ保存されており,その遺伝子の破壊植物は胚性致死になるものの1),発現抑制植物ではオートファジーが活性化することが観察される2).TORキナーゼによって負に制御されるATG1/ULK複合体は,出芽酵母ではATG1, ATG13, ATG17, ATG29, ATG31の五者から,哺乳動物ではATG1の相同タンパク質であるULK1/2, ATG13, ATG17の機能類縁体FIP200, ATG101の四者から構成される3).シロイヌナズナには,4個のATG1, 2個のATG13ホモログが同定されているが4),ATG17とATG29およびATG31に相当するタンパク質は未同定である.その代わり,ATG101のホモログが同定されており,シロイヌナズナATG1aとATG13aに加え,ATG101自身と相互作用することが報告されている5).さらに,ATG101はシロイヌナズナATG11ホモログとも結合する.上述のように植物ではATG17ホモログは見つかっていないものの,ATG11タンパク質内にはATG17様ドメインが存在しており,そのドメインを介してATG101と相互作用しているとの報告がある5).ATG11は酵母では選択的オートファジーに関与しており,欠損してもバルクオートファジーには影響がない.ATG17様ドメインを持つシロイヌナズナATG11は選択的オートファジーに加え,バルクオートファジーの過程においても機能している可能性がある.
シロイヌナズナにおいて,ATG13aは栄養十分条件下でリン酸化され,栄養飢餓条件下で脱リン酸化される.加えて,ATG1aは哺乳動物と同様に窒素および炭素飢餓条件下でリン酸化される4).さらに,atg13a atg13b二重変異体はオートファジー能を欠損していることが示された4).これらの結果は,植物オートファジーがTORC1シグナル伝達経路により制御されていることを想像させるが,TORキナーゼがATG13を直接リン酸化してATG1との相互作用を妨げることで植物オートファジーを負に制御しているかはまだ証明されていない.また,哺乳動物とは違い,シロイヌナズナATG1aおよびATG13aは栄養飢餓条件下でオートファジー経路によって分解され,それらタンパク質量が劇的に減少する4).オートファジー始動分子であるATG1/13キナーゼ複合体をターゲットとし,分解することで,オートファジー活性のネガティブフィードバックループを形成しているのかもしれない.
植物において,広範囲の非生物的ストレス条件下でオートファジーが活性化されることが観察されている.たとえば,高塩ストレス,浸透圧ストレス,酸化ストレス,小胞体(ER)ストレスなどが植物オートファジーを誘導する6).また,筆者らは,植物ホルモンの一つであるサリチル酸のアゴニスト化合物ベンゾチアジアゾール(BTH)を処理するとオートファジーが誘導されること,そして,それは老化過程や病原菌感染時に増幅するサリチル酸シグナルによって引き起こされる過剰な細胞死を防ぐためのネガティブフィードバックの機能を果たしていることを明らかにしている7).
TORキナーゼを過剰発現させると,窒素および炭素飢餓条件下であっても植物オートファジーが抑制されることがこれまでにすでに報告されている.しかし,最近の研究から,オートファジーを誘導する刺激の種類によってはTORキナーゼ非依存的な経路が存在することが明らかとなってきた.TORキナーゼを過剰発現すると,塩ストレスおよび浸透圧ストレス誘導型オートファジーは窒素・炭素飢餓時と同じように抑制されたが,酸化ストレス,ERストレスおよびサリチル酸誘導型オートファジーは抑制されなかった6).これらの結果から,植物にはTORキナーゼ依存型および非依存型の二つのオートファジー制御経路が存在することが示された.
他の生物と同様,植物でもオートファジー関連(ATG)遺伝子群がN飢餓で発現誘導されることから8),植物オートファジーもN源のリサイクルに重要な役割を果たしていることが予想された.実際に,atg遺伝子破壊シロイヌナズナ(atg変異体)はN飢餓に対し感受性が高く,野生型に比べ早期に黄白化(クロロシス)を起こして枯死してしまう.また,野生型植物ではN飢餓によってオートファジーが誘導されるのが観察されており8),植物が自身の細胞内成分を分解して得たアミノ酸を必要な場所に再分配することで外部環境が好転するまでの時間を稼ぎ,延命を図っていると考えられた.
このN飢餓条件下において,特定のタンパク質に着目した研究が報告されている.シロイヌナズナにおいて,ユビキチンプロテアソーム分解系とオートファジー分解系の関連を調べる中で,26Sプロテアソームの多くのサブユニットタンパク質がatg変異体において増大していることが観察された9).この結果は,植物にもオートファジーによる26Sプロテアソーム複合体の分解,つまり,プロテアファジーが存在することを示している.興味深い点は,この植物プロテアファジーには少なくとも二つの異なる経路が存在することである9).
一つ目の経路はN飢餓誘導型オートファジーである.GFP融合タンパク質形質転換植物を用いたプロセシングアッセイにより,20Sコア粒子サブユニットのPAG1および19S制御粒子の蓋部(Lid)構成サブユニットのRPN5aがN飢餓に伴って分解されることが示された.また,GFP-ATG8植物を用いた共局在解析により,これらの分解はATG8を介するオートファジーによって行われていることが明らかになったが,オートファジーの選択性を決定するNBR1(neighbor of BRCA1 gene 1;植物のNBR1ホモログは動物のp62とNBR1タンパク質の二つの機能の特徴を備え持つハイブリッドタンパク質である)受容体は関与していなかった.
二つ目の経路はプロテアソーム阻害剤誘導型オートファジーである.プロテアソーム阻害剤MG132を処理すると,26Sプロテアソーム複合体が高ユビキチン化され,不活性化された複合体が選択的に分解される.N飢餓誘導型プロテアファジーと異なる点は,選択性を決定する因子が同定されている点である.19S制御粒子のサブユニットの中でも,フリーフォームとして存在することができ,26Sプロテアソーム複合体と結合するという点でユニークな特徴を持つRPN10がその選択性を担っている.RPN10はユビキチン結合モチーフ(UIM)を複数持っており,UIM1でユビキチンと,UIM2においてATG8と結合することで不活性化された26Sプロテアソーム複合体の選択的な分解を導く.
今のところ,N飢餓時のプロテアソーム分解が非選択的なのか,それとも選択的なのかわかっていない.また,それぞれの経路を独立に阻止するような変異体も存在しないため,これら経路の生理的意義は明らかとなっていない.しかし,栄養十分条件であってもオートファジーが不能であると26Sプロテアソーム複合体が高蓄積していることから9),アミノ酸のリサイクリングのためというよりは,巨大なタンパク質複合体の品質管理や細胞内の恒常性維持といった役割を担っているのかもしれない.
植物は無機栄養素Nを硝酸(NO3−)態窒素あるいはアンモニア(NH4+)態窒素として吸収するが,NH4+態窒素はシロイヌナズナでは(植物種によっては)毒性がある.しかし,その毒性機構についてはまだ不明な点が多い.また,N源飢餓に対するオートファジーの役割については非常に多くの記述があるものの,オートファジーとNの解毒との関連についてはこれまでほとんど調べられてこなかった.
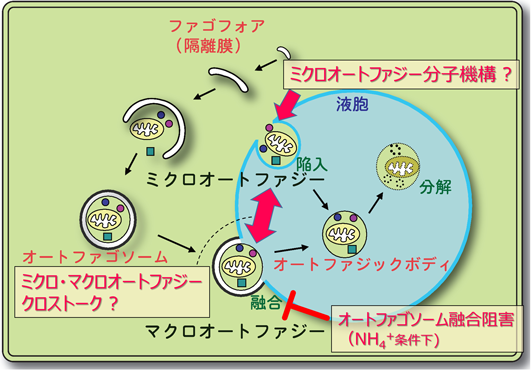
そこで,筆者らは,NH4+態窒素のみを与えたシロイヌナズナにおいて,オートファゴソームの挙動を精査した.その結果,NO3−態窒素を与えたときにはほとんど観察されなかったオートファゴソームが非常に多く蓄積していた(筆者ら未発表データ).この結果はアンモニア毒性時にはオートファジーが亢進していることを示唆した.しかし,液胞型ATPase(V-ATPase)阻害剤コンカナマイシンAを用いてオートファジーフラックスを調査したところ,NH4+条件下ではオートファジックボディの蓄積が阻害されていた.このとき,液胞内のpHにさほど影響がなかったことから,これらの結果は,マクロオートファジーがオートファゴソームと液胞膜の融合の段階で阻害されていることを示唆した(図1).
その一方で,蛍光プローブによる液胞膜の可視化実験により,液胞膜の陥入によるミクロオートファジーが亢進していることが明らかとなった(筆者ら未発表データ).このことから,マクロオートファジーとミクロオートファジーがクロストークし,マクロオートファジーの欠損をミクロオートファジーが相補している可能性が示唆される(図1).どうしてNH4+条件下でオートファゴソームと液胞膜との融合が阻害されるのか,その分子メカニズムの解明は今後の課題である.また,植物では,ミクロオートファジーの現象が数多く報告されているものの,その分子メカニズムはほとんど解明されていない.上述のアンモニア毒性時に観察される「マクロオートファジーが阻害される代わりにミクロオートファジーが誘導される現象」を利用して新たなスクリーニング系を確立すれば,植物ミクロオートファジーの新規分子メカニズムの解明につながると期待される.
シロイヌナズナなどのアブラナ科植物では,P欠乏条件になると主根伸長が阻害され,側根の形成が促進されることがよく知られている.植物は土壌表面のPをなるべく効率よく吸収できるように根系構造を作り変えていると考えられている.最近になって,P欠乏がシロイヌナズナの根端でオートファジーを誘導することが報告された10).通常の栄養十分培地からP欠乏培地に移植後20時間以内にオートファゴソームの数が,特に根端分裂組織および根の成長点と伸長領域の境界の移行領域において増大した.通常栄養条件下に比べ2.5倍もオートファゴソームが高蓄積していた.
面白いことに,このP欠乏誘導型オートファジーはERストレス依存的オートファジーであることが明らかとなった.シロイヌナズナに糖鎖合成阻害薬ツニカマイシンを処理し,人為的にERストレスを引き起こすと,オートファジーが誘導され,小胞体が液胞に運ばれて分解されるが,この過程にはERストレスセンサーのINOSITOL-REQUIRING ENZYME-1b(IRE1b)が必要であることがわかっている.また,熱ショックタンパク質Hsp70に属し分子シャペロンとしてERストレス応答にきわめて重要な機能を果たしているimmunoglobulin heavy-chain binding protein(BiP)の植物ホモログを過剰発現させると,このツニカマイシン誘導オートファジーが起こらないことも知られている.そこで,ireb1変異体やBiP過剰発現体をP欠乏条件にさらして観察したところ,オートファゴソームの蓄積はみられなかった.
では,P欠乏時にオートファジーが起こらないと植物にどのような表現型が現れるのだろうか? 栄養十分培地でもatg変異体の根の伸長は野生型植物に比べ90%程度であるが,P欠乏下では50%にまで伸長が阻害されていた10).さまざまな遺伝子発現マーカーによって根の伸長阻害を根端分裂活性という視点で観察したところ,atg変異体では,P欠乏下で有糸分裂活性が低下していること,細胞分化マーカーが根端上部にまで拡張していること,根の組織形成をコントロールしていると考えられている静止中心(それ自体は分裂しないが,周囲の幹細胞を維持している細胞)の活性が高度に低下していることが明らかとなった.つまり,atg変異体では,根端分裂組織において野生型植物よりも早期に分化が起こることで根の伸長がより阻害されていた.
しかし,P欠乏誘導型オートファジーは細胞内のPをリサイクルするために起きているのではなさそうだ.無機リン酸を化学的にミミックするが代謝はされない亜リン酸(Phi)を添加すると,P欠乏下であってもオートファジーの誘導が抑制された10).また,atg変異体ではP欠乏時に根端分裂活性が低下してしまうが,Phiの添加やFeを培地から抜くことで回復した.このような結果から,P欠乏誘導型オートファジーは核酸などを液胞内でバルクに分解することによってPのリサイクリングに重要であるというより,根端におけるPのセンシングやERストレス応答に働くことで,P欠乏時の根の発達に重要な役割を果たしていると考えられる.
P欠乏下で起こるオートファジーの誘導メカニズムはまだほとんどわかっていないが,TORキナーゼを過剰発現しても抑制されないことが示されている10).今後のさらなる解析により,TORキナーゼ非依存的な植物特異的誘導メカニズムの解明が進むに違いない.
植物はC源を光合成によって獲得するため,長期間暗処理にさらされるとC欠乏に陥る.そのような条件下でatg変異体は野生型よりも早くクロロシスを起こし枯死することから,植物オートファジーのC飢餓適応における重要性が示唆された.培地からC源を枯渇させ,さらに暗処理すると,オートファジーの誘導が観察される11).特によく発達した古い葉において観察され,その過程では葉緑体タンパク質が積極的にかつ選択的に分解されていることがわかっている.Rubisco-containing bodies(RCBs)と呼ばれる葉緑体ストロマタンパク質のみを含む葉緑体胞膜由来の脂質二重膜小胞がそのカーゴである11).野生型植物において,コンカナマイシンA存在下で液胞内の分解を阻害しつつ,葉を暗処理すると,RCBsが液胞内に蓄積するが,atg変異体では蓄積しない.加えて,暗条件下であってもグルコースやスクロースなどの糖を添加するとRCBsは液胞内に蓄積しない.さらに,植物に光を照射して光合成が行える条件であっても,光合成の阻害剤を添加するとRCBsの液胞への輸送は観察されない.RCBsの液胞への輸送はN欠乏条件下では起こらないことから,C欠乏に特異的な応答であった.
では,このRCBsを介したオートファジーによる葉緑体の部分的な分解の生理的意義は何か? 筆者らは,切取葉を用いたin vitro暗処理実験において,atg変異体の葉は1週間以内に光合成活性の低下とともに早期老化を示すことを見いだした.このin vitro実験系を用いて大規模なメタボローム解析を行ったところ,暗処理後,野生型植物で特に分岐鎖アミノ酸が増加するのが観察された.一方,atg変異体ではその増加量が顕著に低下していた(筆者ら未発表データ).シロイヌナズナにおいて,分岐鎖アミノ酸や芳香族アミノ酸の代謝に関わる変異体の解析から,それらアミノ酸の分解物(イソバレリルCoAなど)がミトコンドリアの呼吸鎖に電子を供給する代替基質となりうることが明らかになっている12).植物が光合成を行うことができない状況に陥りC欠乏になると,植物オートファジーが発動され,自身のタンパク質を分解してデンプンに変わる呼吸基質となるアミノ酸(特に分岐鎖アミノ酸)を供給することでエネルギー産生に貢献していると考えられる.しかし今のところ,RCBsがどのようにして選択的に認識され液胞に輸送されるのか,その分子メカニズムは明らかになっていない.
部分的な葉緑体の分解は,RCBs以外にも,デンプン粒を含むsmall starch-like granule(SSLG)bodiesと呼ばれる小胞13)やATG8-interacting protein 1(ATI1)bodiesを介するATGタンパク質に依存したオートファジーに加え14),ATGタンパク質に依存しない二つの小胞経路によっても行われることが報告されている15, 16).植物はこのような複数の分解モードを巧みに調節し適切に使い分けることでしたたかさを獲得しているのかもしれない.
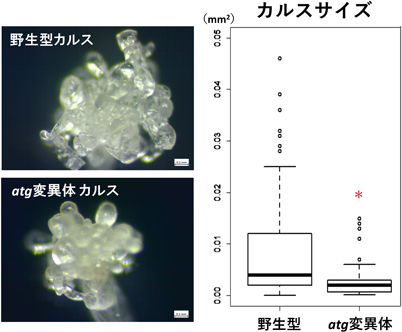
動物細胞では,がん化による無秩序な細胞増殖において,マクロオートファジーが栄養供給という観点でがんの後期過程を正に制御していることが明らかになっている.一方,植物細胞では,傷ストレスを受けると無定形で無方向に増殖するという点でがん組織によく似た細胞塊(カルス)が発生するが,その形成過程におけるオートファジーの関与はまったく明らかになっていなかった.筆者らは,植物オートファジーのカルス形成への関与を明らかにすることを目的とし,野生型植物とatg変異体における傷ストレス後のカルス形成について調査した.暗所で1週間生育させた実生の胚軸の葉側と根側両方を切断後,さまざまな栄養素欠乏培地に移植し,カルス形成の頻度とカルスのサイズを定量測定して比較した.これまでに,栄養十分およびN欠乏条件下では野生型と大きな違いがみられなかったものの,C欠乏条件下において,atg変異体でカルス形成頻度およびカルスサイズが顕著に減少するという結果が得られている(図2,筆者ら未発表データ).また,特にカルスサイズについて葉側と根側で異なった挙動も観察されている.オートファジーがどのようにカルス形成に関与しているのか詳細は不明だが,カルス形成には植物ホルモンのオーキシンやサイトカイニンが深く関わっていることから,一次代謝物を介したホルモン生合成系へのオートファジーの関与も考えられ,大変興味深い課題の一つである.
シロイヌナズナにおいて,TORキナーゼ依存的オートファジーがS欠乏条件下において栄養素Sのリサイクリングに関与していることが示唆されている17).S欠乏条件下では,S6キナーゼのリン酸化の程度が低下しており,TORキナーゼの活性が低下していることがわかった.また,このとき,細胞内のグルコースレベルも減少していた.そのような状況でオートファジーが誘導されるのが観察される.さらに,システイン生合成経路においてSを亜硫酸イオンから供給する亜硫酸還元酵素(SiR)の変異体においてもオートファジーの亢進が観察された.この結果は,亜硫酸の還元のステップとTORキナーゼの活性化がリンクしており,システイン生合成のためのS源供給の低下が感知されオートファジーが誘導されていることを示唆する.
タバコにおいてS欠乏条件下で発現誘導される遺伝子UP9/LSU(Low Sulfur Upregulated)の産物と相互作用する因子が同定されている18).そのタンパク質はオートファジーに選択性を決定するカーゴ受容体のNBR1のホモログであった.実際にS欠乏条件下でUP9あるいはUP9以外のNBR1相互作用因子がオートファジーによって選択的に分解されているのかわかっていないが,この結果から,S飢餓適応におけるオートファジーの関与が示唆される.
上述のように,オートファジーが主要要素のN, P, CおよびSの飢餓適応に重要であることから,その他の必須元素の欠乏適応についても関与していることが予想される.しかし,植物オートファジーと微量必須元素や金属元素との関係の解明はあまり進んでいない.
世界中の農耕地の50%がZn欠乏土壌であるといわれており,Zn欠乏は作物生産においてグローバルレベルで最も重要な欠乏症の一つである.Zn欠乏土壌で生産される作物の収量は著しく低下する.また,その品質は著しく損なわれ,それらを食する人々に深刻な健康被害をもたらす.したがって,Zn欠乏症は農業上とても重要な問題であるが,植物のZn欠乏耐性メカニズムはほとんど明らかになっていない.また,細胞内Znは補因子として酵素と結合しているため,オートファジーの標的になりうると容易に想像される.そこで,筆者らは,必須金属元素の中でも特にZnに注目し,その欠乏適応における植物オートファジーの関与について調査した.
野生型植物とatg変異体をZn量が十分な培養液中で一定期間生育させた後,Zn欠乏培養液に移植して表現型を比較したところ,atg変異体は移植後3日目から早期の生育遅延とクロロシスを示し,7日目には野生型植物より早く枯死した(筆者ら未発表データ).また,Zn欠乏移植18時間後にオートファジー活性の上昇が観察された.これらの結果は,植物オートファジーが細胞内のZn恒常性維持に重要な役割を果たしていることを示唆する.Zn欠乏時にatg変異体で多数のオルガネラマーカータンパク質が蓄積していたことから,Zn欠乏誘導型オートファジーは非選択的分解であると考えられる.出芽酵母においてZn欠乏がTORキナーゼ依存的に非選択的オートファジーを誘導することが報告されているが19),植物においてZn欠乏誘導型オートファジーがTOR依存的かまだわかっていない.
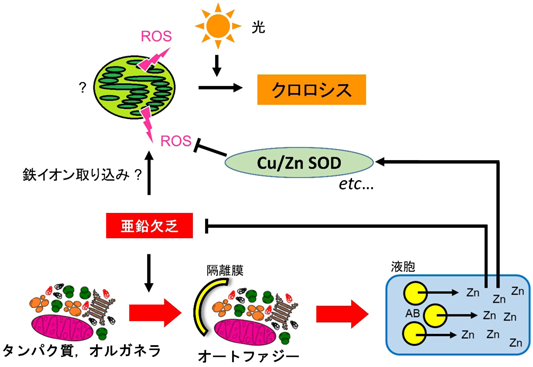
興味深いことに,atg変異体のZn欠乏クロロシスは光強度に依存しており(筆者ら未発表データ),これは強光下で作物のZn欠乏症状が激しくなるという報告20)と一致していた.したがって,atg変異体はZn欠乏をより強く感じていると考えられる.実際,遊離Znイオンと反応してタンパク質に蛍光を導入するプローブを用いた標識実験によって,atg変異体では野生型植物よりも遊離Znが少ないことが示された.加えて,atg変異体でZn要求性酵素の活性低下が観察された.酸化ストレス応答に重要なスーパーオキシドジスムターゼ(SOD)の活性を測定したところ,総SOD活性に対するCu/Zn型SOD活性がatg変異体において著しく低下していた(筆者ら未発表データ).この活性低下は,酸化ストレスを亢進させ,Zn欠乏症状を加速させる一要因になっていると推測される.オートファジーは,Zn欠乏条件下でタンパク質やオルガネラを分解してZnイオンを回収し,必要な場所に再分配していると考えられる(図3).オートファジーの活性化によりZn再利用効率が上昇することで,一時的に細胞内Znの恒常性維持が図られ,Zn要求性酵素の活性維持,そして光合成由来の活性酸素種による細胞障害の回避が可能となり,欠乏症状が緩和されるようになるのだろう.
植物における老化はただ単に死にゆく過程ではなく,遺伝的にプログラムされ高度に調節された過程であり,能動的に細胞死を導くための最終的な成長段階である.老化時には細胞内分解系が活発となり,葉緑体のクロロフィル,タンパク質,脂質およびその他の生体高分子は分解され,葉が完全に枯死する前にアミノ酸や糖分などの栄養素として篩管を通り,老化葉から種子などの繁殖器官へと輸送される.この過程は転流と呼ばれ,移動することのできない植物にとって重要である.特にN転流はN欠乏条件で生育している農作物において生産性・収率を決定する大変重要な過程である.
栄養として与えるN源に安定同位体15Nで標識した硝酸を用いたパルスチェイス実験により,オートファジーがN転流の高効率化に貢献していることが示されている21).栄養十分培地で生育させた植物に15Nで標識した硝酸を一晩根から取り込ませ,その後,通常の培地に戻して種子がとれるまで生育させた.そして,葉の新規合成タンパク質に取り込まれた15Nのうち何パーセントが種子に輸送されたかをトレースして,野生型植物とatg変異体で比較した.その結果,atg変異体ではNの転流効率が低下しており,植物オートファジーが古い器官から新しい器官へのNの転流に寄与していることが明らかとなった.
N転流に加え,最近,Fe, Zn, Mnの種子への効率的な転流にもオートファジーが関与していることが報告されている22).Fe欠乏条件下において,atg変異体では,葉などの栄養組織中のFe量が野生型植物よりも多く検出され,その一方で種子中のFe量は低下していた.つまり,オートファジーが欠損すると老化葉から種子へのFe転流効率が低下する.ミネラルの転流にもオートファジーが重要な役割を果たしているようだ.しかし,atg変異体であっても各栄養素の転流が完全にできなくなるわけではない.植物はさまざまな過酷な環境に耐え,次世代に多く子孫を残すために,バックアップシステムとして複数の栄養素転流経路を発達させているのかもしれない.
最近の研究から,固着性で独立栄養生物であるがゆえの植物特異的なオートファジーの生理的意義が次々と明らかになってきている.他の生物とは栄養素の獲得方法,代謝様式などにおいて一線を画している植物は,ユニークで多彩なオートファジー経路を発達させてきたに違いない.しかしながら,詳細な分子機構を明らかにしなければ,植物オートファジーが各々の現象に能動的かつ直接的に機能しているのか確信できず,本当の意味での生理機能の理解は不可能である.今後のさらなる詳細な分子機構の解明により,植物の巧みな環境応答システムとその進化の過程の理解が進むに違いない.
引用文献References
1) Menand, B., Desnos, T., Nussaume, L., Berger, F., Bouchez, D., Meyer, C., & Robaglia, C. (2002) Expression and disruption of the Arabidopsis TOR (target of rapamycin) gene. Proc. Natl. Acad. Sci. USA, 99, 6422–6427.
2) Liu, Y. & Bassham, D.C. (2010) TOR is a negative regulator of autophagy in Arabidopsis thaliana. PLoS One, 5, e11883.
3) Mizushima, N., Yoshimori, T., & Ohsumi, Y. (2011) The role of Atg proteins in autophagosome formation. Annu. Rev. Cell Dev. Biol., 27, 107–132.
4) Suttangkakul, A., Li, F., Chung, T., & Vierstra, R.D. (2011) The ATG1/ATG13 protein kinase complex is both a regulator and a target of autophagic recycling in Arabidopsis. Plant Cell, 23, 3761–3779.
5) Li, F., Chung, T., & Vierstra, R.D. (2014) AUTOPHAGY-RELATED11 plays a critical role in general autophagy- and senescence-induced mitophagy in Arabidopsis. Plant Cell, 26, 788–807.
6) Pu, Y., Luo, X., & Bassham, D.C. (2017) TOR-dependent and -independent pathways regulate autophagy in Arabidopsis thaliana. Front. Plant Sci., 8, 1204.
7) Yoshimoto, K., Jikumaru, Y., Kamiya, Y., Kusano, M., Consonni, C., Panstruga, R., Ohsumi, Y., & Shirasu, K. (2009) Autophagy negatively regulates cell death by controlling NPR1-dependent salicylic acid signaling during senescence and the innate immune response in Arabidopsis. Plant Cell, 21, 2914–2927.
8) Yoshimoto, K., Hanaoka, H., Sato, S., Kato, T., Tabata, S., Noda, T., & Ohsumi, Y. (2004) Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell, 16, 2967–2983.
9) Marshall, R.S., Li, F., Gemperline, D.C., Book, A.J., & Vierstra, R.D. (2015) Autophagic Degradation of the 26S proteasome is mediated by the dual ATG8/ubiquitin receptor RPN10 in Arabidopsis. Mol. Cell, 58, 1053–1066.
10) Naumann, C., Müller, J., Sakhonwasee, S., Wieghaus, A., Hause, G., Heisters, M., Bürstenbinder, K., & Abel, S. (2019) The local phosphate deficiency response activates endoplasmic reticulum stress-dependent autophagy. Plant Physiol., 179, 460–476.
11) Ishida, H., Yoshimoto, K., Izumi, M., Reisen, D., Yano, Y., Makino, A., Ohsumi, Y., Hansen, M.R., & Mae, T. (2008) Mobilization of rubisco and stroma-localized fluorescent proteinsof chloroplasts to the vacuole by an ATG gene-dependentautophagic process. Plant Physiol., 148, 142–155.
12) Araújo, W.L., Tohge, T., Ishizaki, K., Leaver, C.J., & Fernie, A.R. (2011) Protein degradation—An alternative respiratory substrate for stressed plants. Trends Plant Sci., 16, 489–498.
13) Wang, Y., Yu, B., Zhao, J., Guo, J., Li, Y., Han, S., Huang, L., Du, Y., Hong, Y., Tang, D., et al. (2013) Autophagy contributes to leaf starch degradation. Plant Cell, 25, 1383–1399.
14) Michaeli, S., Honig, A., Levanony, H., Peled-Zehavi, H., & Galili, G. (2014) Arabidopsis ATG8-INTERACTING PROTEIN1 is involved in autophagy-dependent vesicular trafficking of plastid proteins to the vacuole. Plant Cell, 26, 4084–4101.
15) Wang, S. & Blumwald, E. (2014) Stress-induced chloroplast degradation in Arabidopsis is regulated via a process independent of autophagy and senescence-associated vacuoles. Plant Cell, 26, 4875–4888.
16) Otegui, M.S., Noh, Y.S., Martínez, D.E., Vila Petroff, M.G., Staehelin, L.A., Amasino, R.M., & Guiamet, J.J. (2005) Senescence-associated vacuoles with intense proteolytic activity develop in leaves of Arabidopsis and soybean. Plant J., 41, 831–844.
17) Dong, Y., Silbermann, M., Speiser, A., Forieri, I., Linster, E., Poschet, G., Allboje Samami, A., Wanatabe, M., Sticht, C., Teleman, A.A., et al. (2017) Sulfur availability regulates plant growth via glucose-TOR signaling. Nat. Commun., 8, 1174.
18) Zientara-Rytter, K., Lukomska, J., Moniuszko, G., Gwozdecki, R., Surowiecki, P., Lewandowska, M., Liszewska, F., Wawrzyńska, A., & Sirko, A. (2011) Identification and functional analysis of Joka2, a tobacco member of the family of selective autophagy cargo receptors. Autophagy, 7, 1145–1158.
19) Kawamata, T., Horie, T., Matsunami, M., Sasaki, M., & Ohsumi, Y. (2017) Zinc starvation induces autophagy in yeast. J. Biol. Chem., 292, 8520–8530.
20) Cakmak, I. (2000) Tansley Review No. 111, Possible roles of zinc in protecting plant cells from damage by reactive oxygen species. New Phytol., 146, 185–205.
21) Guiboileau, A., Yoshimoto, K., Soulay, F., Bataille, M.P., Avice, J.C., & Masclaux-Daubresse, C. (2012) Autophagy machinery controls nitrogen remobilization at the whole-plant level under both limiting and ample nitrate conditions in Arabidopsis. New Phytol., 194, 732–740.
22) Pottier, M., Dumont, J., Masclaux-Daubresse, C., & Thomine, S. (2019) Autophagy is essential for optimal translocation of iron to seeds in Arabidopsis. J. Exp. Bot., 70, 859–869.
著者紹介Author Profile
 吉本 光希(よしもと こうき)
吉本 光希(よしもと こうき)明治大学農学部生命科学科准教授.博士(食品栄養科学).
略歴1972年静岡県に生る.95年静岡県立大学食品栄養科学部卒業.97年同大学院生活健康科学研究科博士前期課程修了.2001年同大学院同研究科博士後期課程単位取得の上退学.同年学位取得.01~07年基礎生物学研究所博士研究員.07~10年理化学研究所基礎科学特別研究員.10~11年同研究所植物科学研究センター研究員.11~15年フランス国立農学研究所独立研究員.16年より現職.
研究テーマと抱負現在は主に植物の環境ストレス適応におけるオートファジーの役割について研究.様々なタイプのオートファジーを分子レベルで明らかにすることで植物の強かさや巧みな生存戦略の一端を紐解いていきたい.
ウェブサイトhttps://meiji-lifesci.jp/master/%e5%90%89%e6%9c%ac%e3%80%80%e5%85%89%e5%b8%8c/
趣味蕎麦打ち.