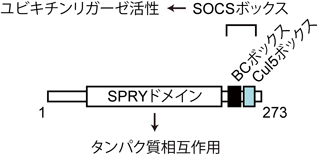
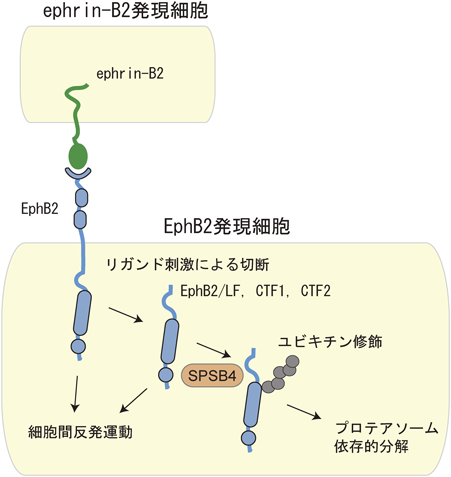
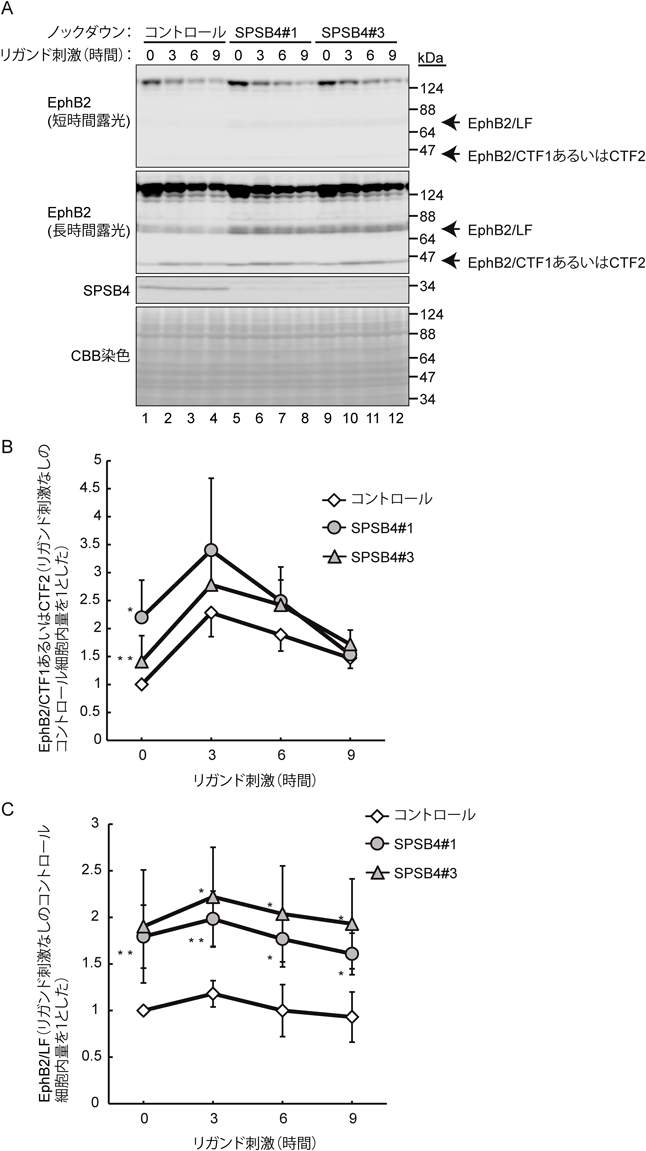
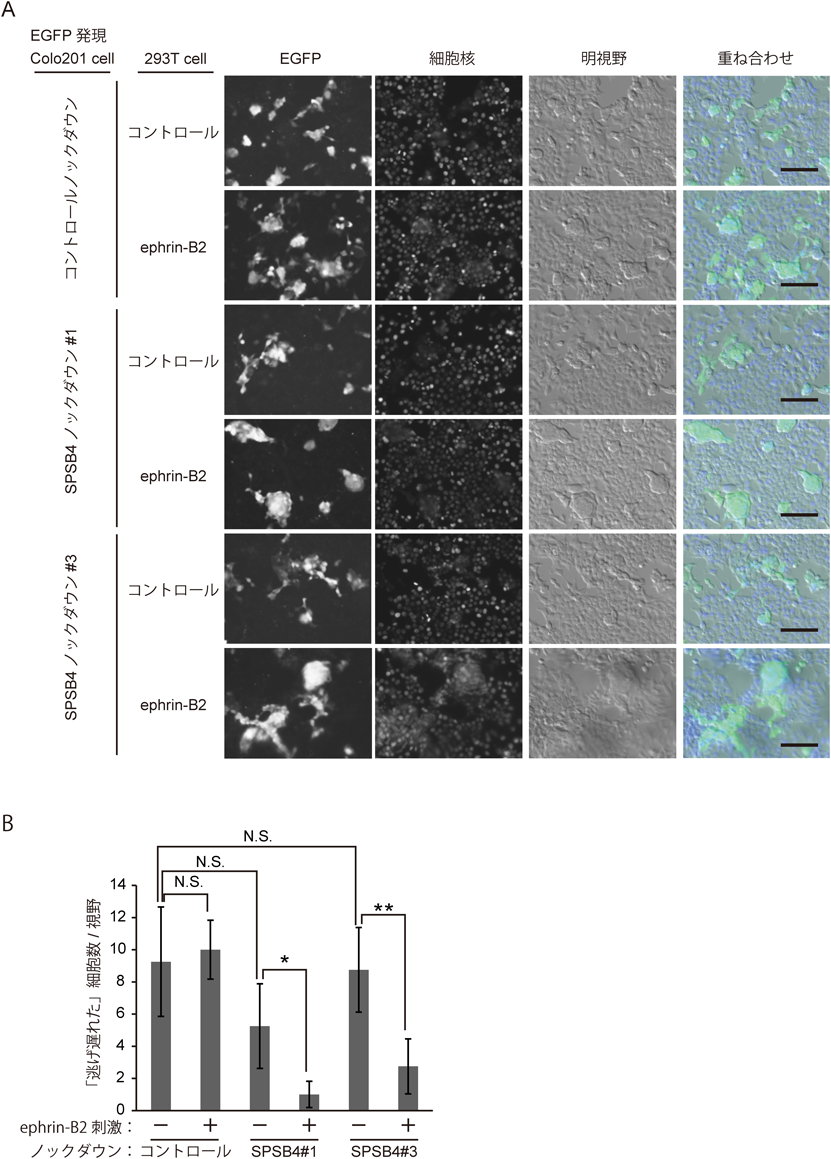
1回膜貫通タンパク質EphB2のユビキチン-プロテアソーム系による分解Ubiquitin-proteasome-dependent degradation of single-pass transmembrane protein EphB2
1 福岡女子大学国際文理学部食・健康学科Department of Food and Health Sciences, International College of Arts and Sciences, Fukuoka Women’s University ◇ 〒813–8259 福岡県福岡市東区香住ケ丘1–1–1 ◇ A-603 Fukuoka Women’s University, 1–1–1 Kasumigaoka, Higashi-ku, Fukuoka, 813–8529, Japan
2 名古屋大学大学院理学研究科Department of Biological Science, School of Science, Nagoya University Division of Biological Science, Graduate School of Science, Nagoya University ◇ 〒464–8602 愛知県名古屋市千種区不老町 ◇ Aichi 464–8602, Japan