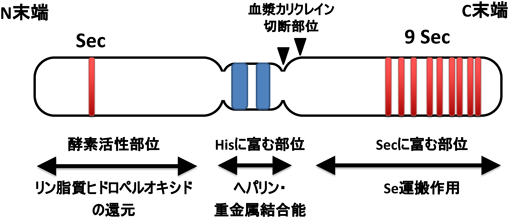
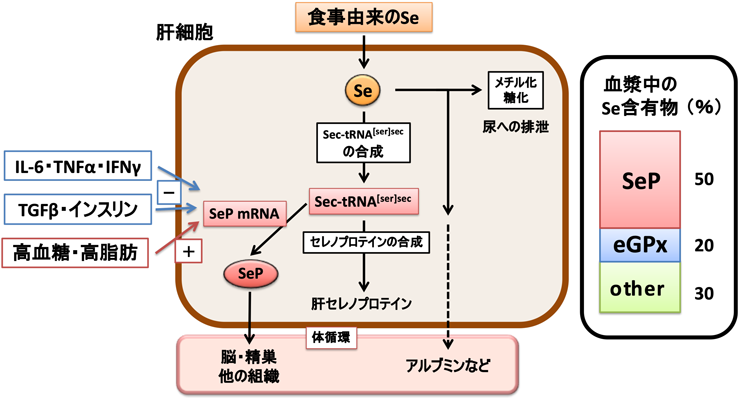
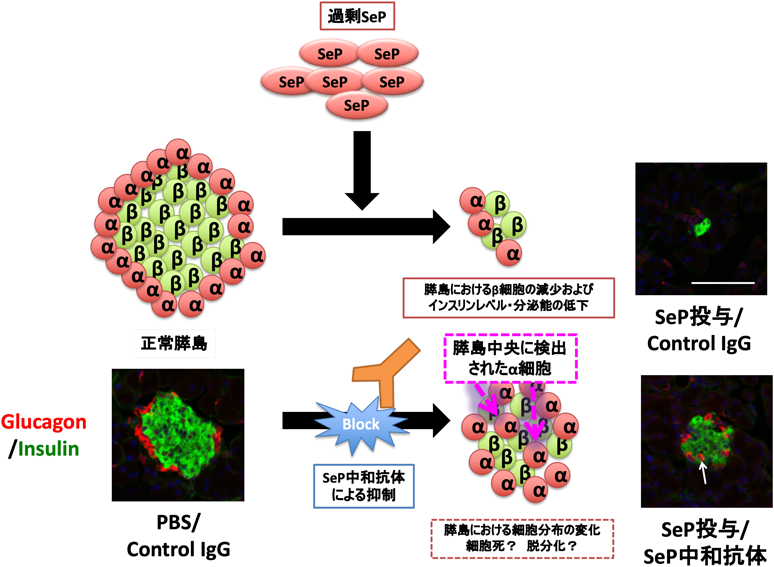
セレノプロテインPの機能と疾患——疾患バイオマーカーとしての可能性Function of selenoprotein P and relation to diseases——Possibility as a disease biomarker
東北大学大学院薬学研究科代謝制御薬学分野Laboratory of Molecular Biology and Metabolism, Graduate School of Pharmaceutical Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 C301 ◇ C301, 6–3 Aoba, Aramaki, Aoba-ku, Sendai, Miyagi 980–8578, Japan