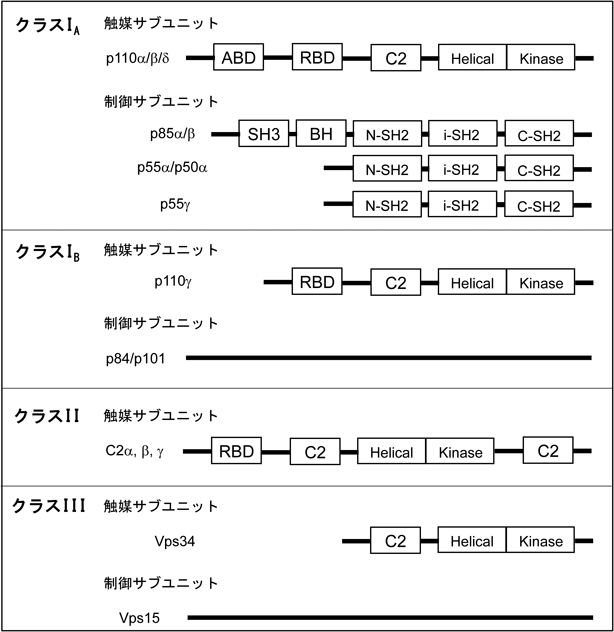
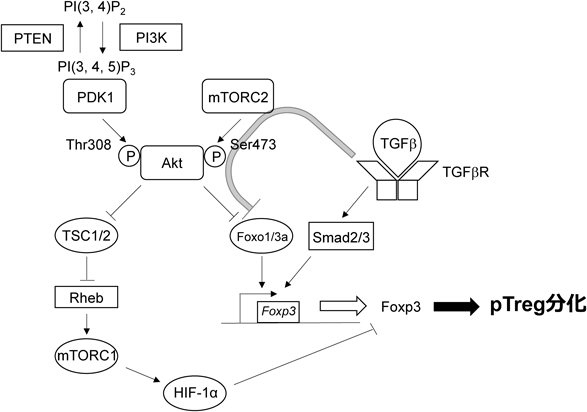
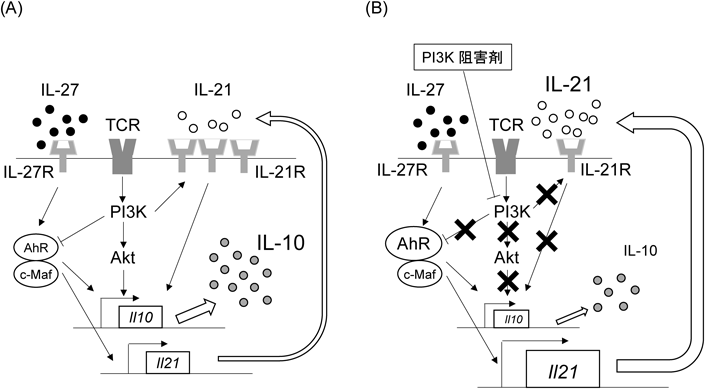
免疫応答を制御するヘルパーT細胞の分化とPI3K経路Role of PI3K pathway on immunoregulatory helper T cell differentiation
東京医科歯科大学大学院医歯学総合研究科分子免疫学分野Department of Molecular Immunology, Graduate School of Medicine and Dental Sciences, Tokyo Medical and Dental University (TMDU) ◇ 〒113–8549 東京都文京区湯島1–5–45 ◇ 1–5–45 Yushima, Bunkyo-ku, Tokyo 113–8549, Japan