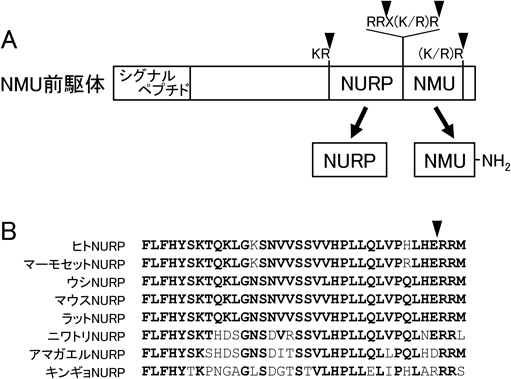
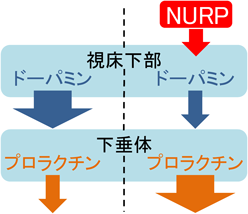
プロラクチン分泌促進活性を持つ新たな生理活性ペプチドの発見Identification of a novel neuropeptide with prolactin-releasing activity
国立循環器病研究センター研究所生化学部Department of Biochemistry, National Cerebral and Cardiovascular Center Research Institute ◇ 〒564–8565 大阪府吹田市岸部新町6–1 ◇ 6–1 Kishibe Shinmachi, Suita, Osaka 564–8565, Japan