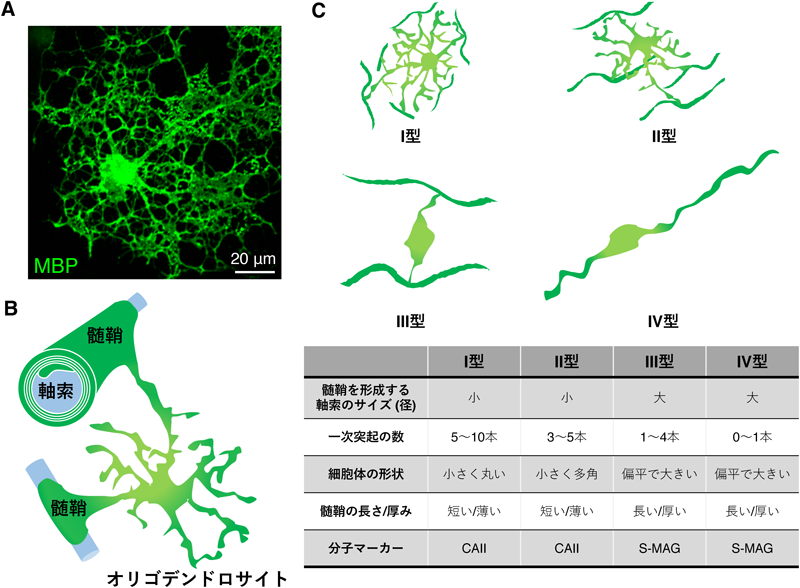
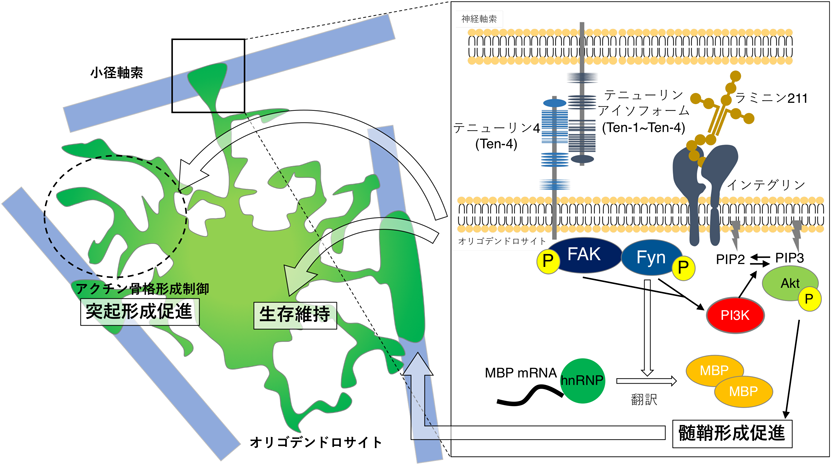
中枢神経系の髄鞘形成におけるオリゴデンドロサイトの多様性Morphological and Functional Diversity of Oligodendrocytes in the Central Nervous System
東京医科歯科大学大学院医歯学総合研究科Graduate school of Medical and Dental Sciences, Tokyo Medical and Dental University ◇ 〒113–8510 東京都文京区湯島1–5–45 ◇ 1–5–45 Yushima, Bunkyo-ku, Tokyo 113–8510, Japan