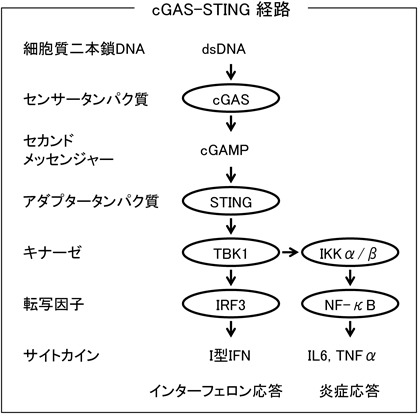
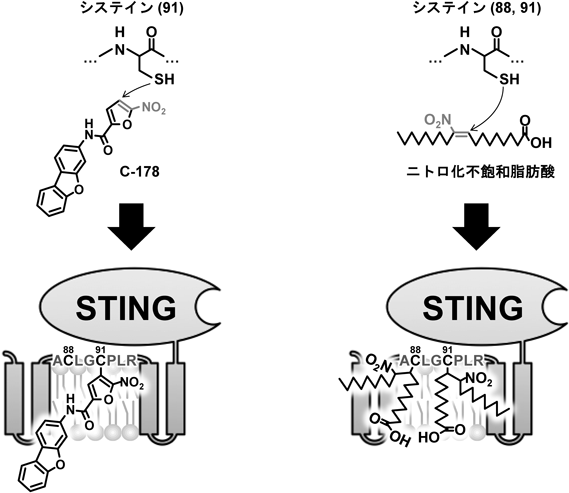
脂質修飾依存的なSTING活性化を中心とした自然免疫の分子機構The molecular mechanism underlying the activation of STING, a central signaling molecule in the innate immune response to cytosolic nucleic acids
東北大学大学院生命科学研究科細胞小器官疾患学分野Laboratory of Organelle Pathophysiology, Department of Integrative Life Sciences, Graduate School of Life Sciences, Tohoku University ◇ 〒980–8578 宮城県仙台市青葉区荒巻字青葉6–3 ◇ Aobayama, Aoba-ku, Sendai, Miyagi, 980–8578, Japan