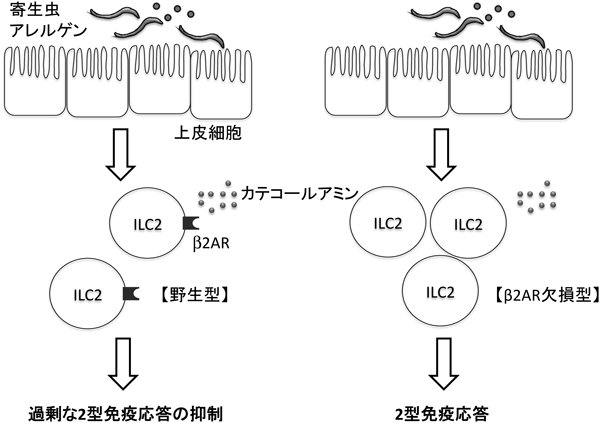
神経系による2型自然リンパ球と2型炎症応答の制御Neuronal regulation of group 2 innate lymphoid cells and type 2 inflammation
Jill Roberts Institute for Research in Inflammatory Bowel Disease, Joan and Sanford I. Weill Department of Medicine, Department of Microbiology and Immunology, Weill Cornell Medicine, Cornell UniversityJill Roberts Institute for Research in Inflammatory Bowel Disease, Joan and Sanford I. Weill Department of Medicine, Department of Microbiology and Immunology, Weill Cornell Medicine, Cornell University ◇ アメリカ合衆国ニューヨーク州ニューヨーク市413 East 69th Street ◇ 413 East 69th Street, New York, NY 10021, USA