1)光遺伝学的手法について
遺伝子発現の光操作技術は,光遺伝学(optogenetics,オプトジェネティクス)に含まれる技術である1).光遺伝学とは,光に応答して何らかの細胞状態や細胞機能を変化させるような生体分子をコードする遺伝子を,特定の細胞に選択的に導入,もしくは発現させ,光操作を行う実験技術である.光作動性の分子は,植物や細菌などに由来するものがそのまま使用される場合もあるが,多くはその機能を増強したり修飾するような,分子進化が施されているケースが多い.種々のベクターや遺伝子改変動物技術を用いることで,光作動性の分子をコードする遺伝子を,狙った細胞に特異的に発現させ,光操作をする点が「光遺伝学」の名前の由来である.組織・細胞種特異的プロモーターや,Cre/loxPシステムなどと組み合わせることで,所望の細胞特異的な光操作が可能になっている.
2)光遺伝学的手法の利点について
前述したように,光遺伝学的手法の利点は特異的な細胞に光応答性を付与することができる点であるが,他の遺伝学的手法に比べて優れている点は,その時間的・空間的分解能のよさである2, 3).たとえば,ニューロン(神経細胞)の活動をさまざまな薬剤・化合物を用いて操作することが可能であるが,操作したい細胞へ薬剤が到達するための時間や,除去されるまでの時間については,秒~時間スケールの時間が必要になる.残留性の高い薬物については,数日単位の除去時間が必要になるケースがある.それに比較して,光ははるかに優れた時間分解能で操作することが可能である.たとえば,ニューロンの中には100 Hzを超える周波数でバースト発火するような細胞が存在する.そのような速い変化を人工的に再現するには,光は理想的な媒体であると考えられる.このような周波数で光のオン・オフをコントロールすることはたやすく,光遺伝学的手法を用いることで,マイクロ~ミリ秒オーダーの神経活動の活性化あるいは抑制が可能である2, 3).
また,さまざまな光デバイスを用いることで,狙った細胞特異的に光を照射することが可能である.上記の薬剤を用いたケースでは,たとえ限局的に薬剤を投与することができても,拡散による空間分解能の減少を回避することはできない.したがって,空間分解能という意味でも,光遺伝学的手法は,既存の薬剤・低分子化合物や温度を媒体とした操作ツールに加えて,優位性があると考えられる.
このように,光遺伝学的手法は,その優れた時空間分解能という点で,既存の手法の限界を凌駕する実験手法になると期待されるが,一方で,光デリバリーの限界や侵襲性の問題が存在する.たとえば,多くの光遺伝学的手法で使用される青色光は,生体透過性が悪く深部組織への光照射は困難が伴う.そのようなケースでは,光ファイバーを生体組織に挿入することで光照射を実施するケースが多いが,高い侵襲性の問題が発生する.また,生体深部組織中の細胞について,狙った細胞特異的に光操作を実施するためには,光操作ツールの分子開発に加えて,光学デバイスの開発も急務であると考えられる.これらについては,別項にて議論する.
3)光遺伝学的手法の普及について
これらの光遺伝学的手法が広く生命科学研究における標準的ツールとして普及することになったのは,光駆動性のイオンチャネルであるチャネルロドプシン(channelrhodopsin:ChR)の発見と神経科学分野における応用に端を発している2, 3).ChRを含む微生物ロドプシンは,1970年代前半にはすでに発見されていたが,2002年から2003年にかけて,非選択的陽イオンチャネルであるチャネルロドプシン2(ChR2)が同定された.そして,2005年から2006年にかけて,スタンフォード大学のDeisserothの研究グループや,東北大学の八尾らの研究グループが,ChR2を培養神経細胞やマウス脳内の神経細胞に異所性に発現させ,青色光を照射することで,神経活動を人為的に活性化することに成功した.その後,光依存的に神経細胞の活動を抑制できるようなツールも精力的に開発されている.
特定の神経細胞を優れた時空間分解能にて人為的に活性化・不活性化できるツールとして,神経回路研究や神経科学の分野において,光遺伝学的手法は爆発的に普及し,現在は標準的なツールとしての地位を確立したといっても過言ではない.このような神経科学分野における光遺伝学的手法の普及を目にして,他のさまざまな細胞機能の光操作を可能にするツール開発が急速な勢いで進行している.たとえば,現在ではさまざまな細胞シグナルや,細胞運動や形態変化,染色体分配,細胞分化や細胞増殖,外来性の組換え酵素活性などを光を用いて人為的にコントロールする光遺伝学的手法が開発されている1).遺伝子発現の光操作技術もこのような潮流の中で精力的に開発されてきた.以下の節では,遺伝子発現の光操作技術にフォーカスして技術内容と応用例について紹介,議論を行う.
1)光操作の対象や様式について
遺伝子発現の光操作技術については,主として内因性の遺伝子発現の操作を意図したタイプと,外因性の遺伝子発現の操作を意図したタイプの大きく二つに分けられる.前者は,dCas9やTALENなどのゲノム編集に使用されているツールを改変したものを使用し,後者では,Gal4やTetRなどの転写因子の活性を光操作する.また,違ったタイプとしては,CreやFlpなどの組換え酵素の活性の光制御を通して遺伝子発現のオン・オフを制御したり,遺伝子やその制御領域のエピゲノム状態の光制御を行い,遺伝子発現を調節する手法も報告されている.また,遺伝子発現の活性化を光操作するのか,それとも,抑制を光操作するのかについてもツールの使い分けが必要である.
遺伝子発現の光操作技術を用いる優位性については,優れた時間精度でもって人工的操作が可能である旨は上述したが,使用する光操作ツールによってその時間解像度には制限があることが多い.もちろん,照射時間や光量・回数などの光照射のパラメーターを変えることで,さまざまな遺伝子発現パターンのアウトプットを創出することはできるが,使用するツールによって現実的に誘導可能なパターンは決まっているケースもあり,ツールの選択も重要である.また,光誘導する遺伝子発現の量はさほど多くなくてもよいが,細かな変動を再現性よく誘導したい場合と,通常の発現ベクターの一過性遺伝子導入時のように,非常に大きな発現量を誘導したい場合とで,それぞれ適したツールは異なるのが現状であり,適したツールを正しく選択していくことが必要である.以下の項では,主要な光操作ツールとそれらの特性について紹介する.
2)哺乳類細胞における遺伝子発現の光制御の例——外因性遺伝子の制御
2009年に,シロイヌナズナ(Arabidopsis thaliana)由来のFKF1が,哺乳類細胞内においても青色光照射によってGigantea(GI)とヘテロ二量体を形成することがYazawaらによって報告され,青色光感受性の二量体形成スイッチとして機能することが示された4).FKF1は青色光の吸収によって高次構造が変化するLOVドメイン(light, oxygen, voltage domain)を持ち,そのクロモフォア(chromophore,発色団)はフラビンモノヌクレオチド(flavin mononucleotide:FMN)である.FMNは真核生物の細胞内に豊富に存在しており,FKF1-GIを共発現させた細胞では,外因性の薬剤や化合物を投与することなく,二量体形成を青色光照射のみで制御可能であるというメリットがある.Yazawaらは,FKF1-GI光依存性二量体形成スイッチをGal4-UASシステム[酵母由来の転写因子Gal4とGal4のターゲットであるUAS(upstream activating sequence)を用いて,UASに連結した目的とする遺伝子の発現を制御するシステム]と組み合わせることで,遺伝子発現の光制御が可能であることを示したが,光照射依存的に活性化できる遺伝子発現量が数倍程度であった点と,FKF1-GI光依存性二量体形成スイッチはヘテロ二量体の半減期が非常に長く,時間精度のよい制御が不可能であると予想される.また,FKF1とGIは,両者とも分子量が比較的大きなタンパク質であり,各種ベクターへ搭載して哺乳類細胞へ遺伝子導入する際に,影響があると考えられる.しかしながら,他の生物種由来の青色光作動性の多量体形成スイッチを,転写因子複合体の形成に利用することで,哺乳類細胞においても遺伝子発現の光制御が可能となるという事例を先駆的に証明した意義は大きい.Yazawaらの研究グループからは,FKF1-GIシステムを用いた遺伝子発現の光操作システムについて,改良版が報告されている5).
同様にシロイヌナズナ由来のCRY2とCIB1を用いたヘテロ二量体形成スイッチが,哺乳類細胞においても機能することが,Kennedyらによって2010年に報告された6).CRY2のクロモフォアは,同じく哺乳類細胞内に存在するフラビンアデニンジヌクレオチド(flavin adenine dinucleotide:FAD)である.このCRY2-CIB1システムで特徴的な点は,青色光照射を止めて暗条件にすると数秒の時間スケールで二量体が解離するという速い反応特性にある.Gal4-UAS遺伝子発現系を用いて,Cry2-CIB1システムについても遺伝子発現の光制御への応用が可能であることが示された.
CRY2-CIB1システムの時間分解能の速さを考えると,数時間周期での遺伝子発現の振動など,さまざまな遺伝子発現パターンを哺乳類細胞において人工的に光操作できる可能性が開かれたと考えられる.また,遺伝子発現制御とは異なるが,CRY2-CIB1システムは,さまざまな細胞機能の光制御ツールに使用されている.たとえば,細胞シグナル伝達においては,細胞膜上にリクルートされることが活性化のトリガーとなるエフェクター因子が知られており,最近ではAokiらがCRY2-Rafの融合タンパク質を光刺激によって膜上にアンカリングさせたCIB1の近位にリクルートすることで,下流のERKをパルス状に活性化できることを示している7).
CRY2-CIB1システムについては,構成要素の分子進化による改良が進められており,Tuckerらの研究室から,CRY2の光周期が変化する遺伝子点変異が同定され,さらに短い時間幅での光制御や,逆に,より長い時間幅での光制御に適したCRY2誘導体が報告されている8).さらに,二量体形成のバインダー分子であるCIB1についても開発が進められ,不要なドメインを除去することで,暗所での二量体形成のバックグラウンドを下げることにも成功している.
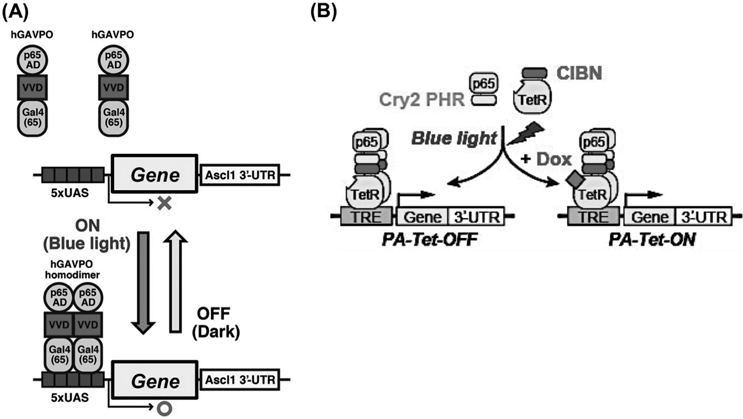
筆者らの研究グループでも,このCRY2-CIB1システムを利用することで,Tetシステムの光制御ツールの開発を進めてきた9).Gal4-UASシステムは,ゼブラフィッシュやショウジョウバエなどのモデル動物では広範に使用されているが,マウスなどの哺乳類モデルやヒト由来の細胞などでの使用例は少ない.これは,転写因子Gal4の長期的な高発現時に細胞毒性が認められる点と,Gal4の結合配列であるUAS配列は,エピゲノム制御によりサイレンシングが起こりやすく,長期的な実験においては不向きである点があげられる.このため,Gal4-UASシステムを用いたトランスジェニックマウスや,遺伝子安定発現細胞株の樹立は,困難であることが多い.したがって,哺乳類細胞や動物モデルにおいて標準的に使用されているTetシステムの光制御化の開発は急務であった.我々が開発したPA-Tet-ON/OFFシステム(図1B)では,CRY2-CIB1システムを使用しているため,速い遺伝子発現のオン・オフが可能である.また,本来Tetシステムは,ドキシサイクリン(doxycycline:Dox)という低分子化合物を用いて遺伝子発現をコントロールするものであるが,PA-Tet-ON/OFFシステムにおいても,Doxによる制御活性は同様に保たれていた.したがって,PA-Tet-ON/OFFシステムにおいては,遺伝子発現制御を,青色光とDoxにおいて二重制御することが可能であり,より信頼性の高い遺伝子発現操作が可能になっている9).
また,アカパンカビ(Neurospora crassa)由来のVVD(Vivid)タンパク質を,光活性化に利用した遺伝子発現制御システムについても報告されている.VVDは最も分子量が小さい光受容体の一つであり,融合タンパク質作製時の二次的影響を最低限にとどめられると期待される.VVDもLOVドメインを持ちFADをクロモフォアとして使用し,青色光吸収によって立体構造が変化することでホモ二量体形成を光誘導できる.2012年にはYangらのグループによって,VVDを利用した光制御可能なGal4-UASシステムが報告された(LightOnシステム)10)(図1A).LightOnシステムは,二量体化能を減弱したGAL4のDNA結合ドメイン,LOVドメインを持つVVD,そして転写活性化因子p65の転写活性化ドメインがタンデムに連結された人工転写因子(GAVPO)を使用しており,光作動性のGal4-UASシステムである.GAVPOと同時に,GAL4の結合配列(5×UAS)にTAT Aボックスを連結し,その下流に発現させたい遺伝子を配置したコンストラクトを細胞に導入する.すると,GAVPOタンパク質は,VVDを介して青色光照射依存的にホモ二量体化を起こす.その結果,GAL4部分の二量体化によりDNA結合活性が増加し,5xUASに結合する.次に,GAVPOのp65を介して転写複合体がTAT Aボックス上に形成され,下流の遺伝子の転写が促進されるという作用機序である.LightOnシステムは光依存的な転写活性のオン・オフが速く,CRY2-CIB1を用いたシステムと同様に,さまざまな遺伝子発現パターンの人工的操作が可能である.また,他の遺伝子発現光操作システムと比較して,LightOnシステムは誘導できる遺伝子発現量が大きく,生物学研究への適応例が最も多いシステムであり,今後のさらなる改良が期待される11, 12).欠点としては,GAVPOの高発現時に,暗所でもリーク活性が生じてしまう点である.LightOnシステムの高い遺伝子発現誘導能を維持しつつ,リーク活性を下げるような改良が期待される.
3)哺乳類細胞における遺伝子発現の光制御の例——内因性遺伝子の制御
内在性の遺伝子発現の制御についても,光操作の手法が拡張している.これらは,ゲノム編集に使用されているツールを遺伝子発現制御に利用している.たとえば,2013年には,Zhangらのグループによって,CRY2-CIB1系とTALEの融合タンパク質を用いた青色光作動性の転写活性化システムが報告された13).TALEは植物の病原菌(Xanthomonas)由来のDNA結合タンパク質で,結合する塩基配列(遺伝子座)を任意かつ人工的にデザインすることができる.培養細胞にとどまらず,CRY2-VP64とTALE-CIB1のペアをアデノ随伴ウイルス(AAV)ベクターで遺伝子導入し,ニューロンや成体脳において内因性のゲノム遺伝子座からの転写を光誘導できることを示した(LITEシステム).さらに,転写活性化ドメインであるVP64をエピゲノム修飾因子の機能ドメインに置換することで,任意の遺伝子座のエピジェネティックな状態を光制御できることも示した(epiLITEシステム).
ゲノム編集のツールが,CRISPR/Cas9を利用したシステムに移行しているように,内在性の遺伝子発現の制御についてもCRISPR/Cas9の変異体を利用した系の開発が進んでいる.Satoらの研究グループによって,変異型CRISPR-Cas9(dCas9)を用いた遺伝子発現制御系にCRY2-CIB1システムを導入し,ゲノム遺伝子の光制御が可能であることが示された14).標的配列を規定するために,ガイドRNAを同時に細胞に導入・発現させる必要があるが,CRISPR-Cas9関連の技術開発のスピードは著しく,光制御についてもさらなる開発が期待される.また,Satoらの研究グループは,上述のVVDに変異導入を行い,光依存性のヘテロ二量体形成システムとしたMagnetシステムの開発を行っており,これを用いた内因性遺伝子の光制御システムの開発も報告している15, 16).
4)哺乳類細胞における遺伝子発現の光制御の例——組換え酵素を用いた例
Cre/loxPシステムを用いてコンディショナルに遺伝子欠損や遺伝子発現誘導を実施することが可能である.トラスジェニックやノックイン動物を用いることで,モデル動物個体内の特異的な臓器や細胞種において選択的に遺伝子操作が可能であり,さまざまな局面で広範に使用されている.Cre/loxPシステムだけでなく,Flp/FrtシステムやDre/roxシステムなど,組換え酵素を利用した遺伝子発現制御は,現在は標準的なツールとして普及している.Cre, Flp, Dreなどの組換え酵素に光作動性スイッチを内包させることで,光照射依存的な組換え活性の誘導が実現している.たとえば,CRY2-CIB1システムを利用したPA(photo-activatable)-Cre8, 17),Magnetを利用したPA-Cre18),Magnet/VVDを使用したPA-Cre, PA-Flp, PA-Dre19, 20)など,報告が相次いでいる.光駆動型組換え酵素による反応は永続的なものであるため,遺伝子発現のオン・オフの繰り返し制御は不可能であるが,任意のタイミングで光を照射することで,狙った時期に遺伝子組換えを誘導できるという利点がある.また,光を特定の空間領域に照射することで,限局した細胞集団において遺伝子組換えを誘導できる.既存の遺伝子改変動物を用いた手法では,特定の遺伝子プロモーター/エンハンサー活性で規定されるような細胞集団しかターゲットできなかったが,たとえば右脳だけ,左脳だけといった,任意の空間情報を付加して遺伝子組換えを誘導できるようになった点は,大きな技術進歩であると考えられる.他にも有用な遺伝子発現の光操作ツールは数多く報告されているが,紙面の都合上,代表的なものだけを紹介させていただいている.
4. 遺伝子発現の光制御ツール開発の今後の課題について
1)制御光の波長の多色化について
現在使用されている遺伝子発現の光制御システムは,青色光依存的な多量体形成スイッチを利用したものが多い.しかしながら,将来的には赤色光や近赤外光を用いてコントロールできる遺伝子発現制御システムの開発が期待される.例をあげれば,一つの細胞に二つの遺伝子発現の光制御システムを導入し,二つの異なる波長の光を照射して,複数の遺伝子の発現を多色制御するような実験系の樹立が望まれる.また,生体組織透過性のよい長波長光を用いることで,さまざまな深部臓器の遺伝子発現をワイヤレスで光制御できるような実験系の樹立も期待される.
青色光と異なる波長の光感受性タンパク質を適応した遺伝性発現システムの構築例としては,シロイヌナズナ由来のタンパク質UVR8とCOP1の組合わせが,近紫外光(UVB, 280~315 nm)照射によって哺乳類細胞内でヘテロ二量体を形成することが報告され,紫外光駆動性Gal4-UASシステムとして報告されている21, 22).しかしながら,紫外光はDNA損傷を引き起こすため,生細胞へのそのままの利用は懸念が生じるが,570~600 nmの2光子励起によってこの問題は低減できる可能性がある.
また,赤色光感受性の遺伝子発現の光制御システムの報告は,青色光による制御システムより早く,2002年にShimizu-Satoらによって報告されている23).シロイヌナズナ由来の光受容体であるフィトクロム(phytochrome)に赤色光を照射すると,シャペロン分子PIF3と結合し,核内に輸送されることを利用している.しかしながら,フィトクロムのクロモフォアであるphycocyanobilin(PCB)を哺乳類細胞は生合成できないため,細胞や個体に外部から添加あるいは投与する必要があった.最近,PCBの代謝産生に必要な遺伝子を導入することでこの問題を解決する試みが報告されている24, 25).また,発色団の添加が不要な新規の近赤外光制御システムとして,Rhodopseudomonas palustris細菌由来のBphP1-Ppsr2を用いた遺伝子発現制御についても報告されており26, 27),今後の改良が期待されている.
2)光照射デバイスの開発について
上述したように,光遺伝学的手法や遺伝子発現の光操作は,ここ10年強の間に急速に発達してきた技術である.したがって,多くの生命科学研究者,バイオ研究者が簡便に使用できる光照射デバイスの普及についても重要である.現在では,それぞれの研究室がLEDやレーザーなどの光照射デバイスをカスタムし,LabViewなどの制御プログラムを使用して操作しているケースが多いと推察される.このような光照射デバイスの整備が,光遺伝学的手法の導入の障壁になっている場合もあり,より低価格で簡便に導入できる照射デバイスの導入が望まれる.
また,詳細は別の機会に譲らせていただくが,顕微鏡視野内の狙った細胞や細胞集団に対して,限局的に光照射を行うためには,デジタルミラーデバイスや空間位相変調器などの光学機器のセットアップや調整が必要である28).また,三次元組織やオルガノイド中の任意細胞に対して,限局的に信頼性高く光照射を実施するには,多光子レーザーの使用や上記の空間位相変調器などとの組合わせが必要であり,現状では簡単にセットアップが可能な状況であるとはいいがたい.これらの光照射デバイスのコストダウンとともに,安定かつ簡便にバイオ実験が可能な状況が構築されることで,初めて,光遺伝学的手法や遺伝子発現の光操作技術が,標準的な手法として確立されると考えられる.したがって,バイオ研究者や試薬メーカーによる分子開発の継続とともに,光学技術開発の研究者や光学・顕微鏡メーカーが協働して,この分野の技術開発を推進することが期待される.