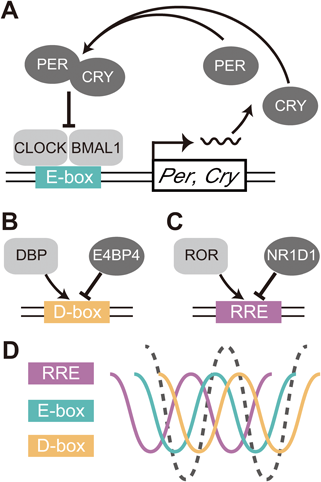
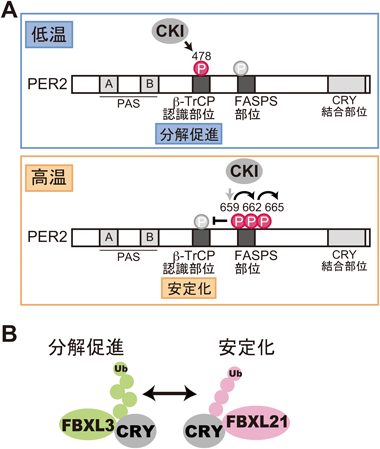
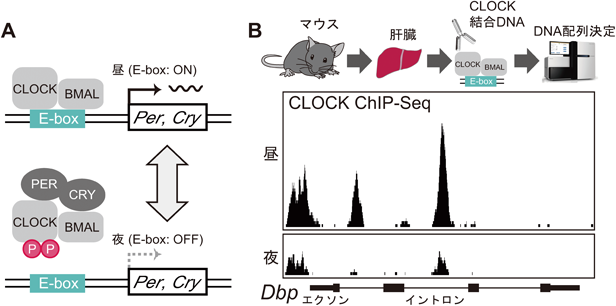
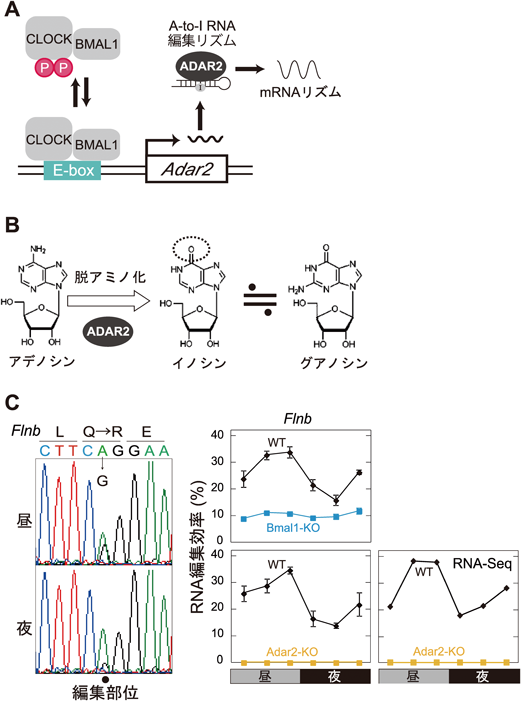
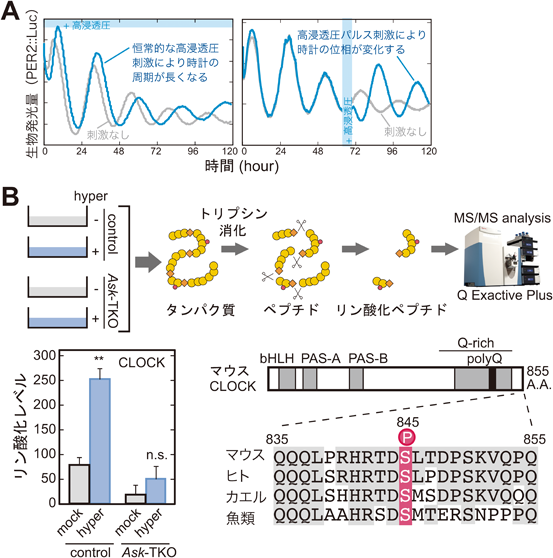
マウス体内時計における時計因子の転写後および翻訳後制御に関する研究Posttranscriptional and posttranslational regulation of rhythmic components in circadian clockwork of mice
東京大学大学院理学系研究科 ◇ 〒113–0033 東京都文京区本郷7–3–1 ◇ The University of Tokyo, 7–3–1 Hongo, Bunkyo-ku, Tokyo 113–0033, Japan