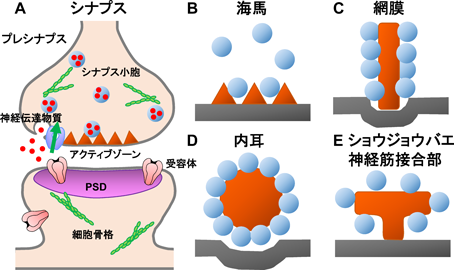
アクティブゾーンは電子顕微鏡による解析から1950年代には形態学的に同定されていたものの,その構成分子については長らく不明であった4, 5).アクティブゾーンはおおよそシナプスを有する生物のプレシナプスにみられる構造体で,進化的にもよく保存され,ポストシナプス肥厚部(postsynaptic density:PSD)ほどではないものの,比較的電子密度が高い(図1).また,アクティブゾーンは生物種や同じ個体でも脳領域ごとに異なった形態を有することも知られている6).たとえば無脊椎動物のなかで最もアクティブゾーンの機能解析が進んでいるショウジョウバエでは,アクティブゾーンはマッシュルーム型で,その特徴的な断面構造からT-barと呼ばれている(図1E).さらに,高等動物の海馬では,ピラミッド型の構造をとり(図1B),網膜や内耳の神経細胞は,リボンシナプスと呼ばれる特殊なアクティブゾーンを有しており,常に数百のシナプス小胞がドッキングしていると考えられている(図1C, D).なぜ,網膜や内耳のシナプスがこのような特殊な形態のアクティブゾーンを有しているのかは明らかになっていないが,おそらく視覚と聴覚は常に末梢からの感覚入力に反応する必要があるため,進化の過程で連続的にシナプス小胞を融合させることができるようなシステムが採用されてきたのではないだろうか.
このように,アクティブゾーンは神経伝達の要となる構造体でもあることから,その構成分子の探索が進められてきたものの,PSDに比べてきわめて小さい構造体なので,精製・単離が難しく古典的な生化学的手法での同定は困難であった.そのような中で,脊椎動物で最初に同定されたアクティブゾーンタンパク質は,線虫UNC13のラットホモログ・Munc13-1である7).さらに,Südhof博士のグループは,低分子量GTP結合タンパク質Rab3Aの結合タンパク質として同定したRIM1がアクティブゾーンタンパク質であることを報告した8).その後,これらに加えて,BassoonとPiccoloが同定された9–11).さらに,2002年に,我々とSüdhof博士のグループが独立してCASTとELKSを同定した12, 13).このように,現在までに,計6種類のタンパク質ファミリーがアクティブゾーンタンパク質として知られている.厳密な定義はないものの,中枢神経において電顕レベルでアクティブゾーンに存在し,かつ強固にプレシナプス形質膜に結合しているタンパク質を指す.したがって,シナプス小胞タンパク質であるRab3Aや,比較的可溶性が高くポストシナプスにも存在するliprinはアクティブゾーンタンパク質としては分類されない.なお,RIM, Munc13, Bassoon/Piccoloに関しては他の詳細な総説をご覧いただきたい14).本稿では,CAST/ELKSタンパク質ファミリーの分子構造とアクティブゾーンタンパク質間の相互作用について概説する.また,遺伝子改変マウスを用いたシナプス可塑性,脳高次機能におけるCAST/ELKSファミリーの役割と生理機能についても最近の話題を提供したい.
3. CAST/ELKSファミリーの分子構造とタンパク質間相互作用
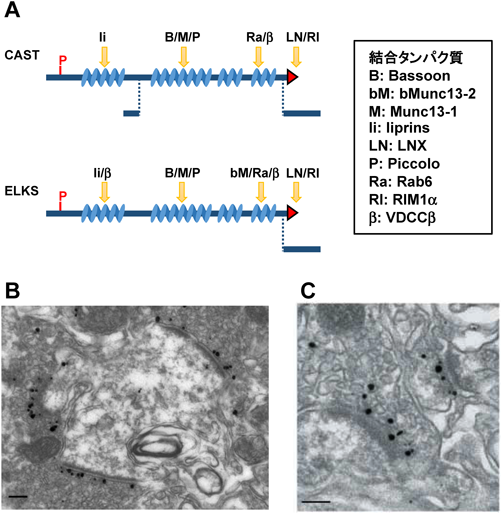
CAST(cytomatrix at the active zone-associated structural protein)は,ラットの脳から最初に精製された120 kDaのタンパク質であり12),その後,分子生物学的手法によってRIM結合タンパク質ERC2としてSüdhof博士のグループが報告した13).一方,ELKSは,もともとある種の甲状腺がんにおいて異なる染色体に転座した遺伝子産物として同定されていた15).その後,我々は,免疫電子顕微鏡を用いて,ELKSがアクティブゾーンに局在していることを見いだした16).CASTは主に脳神経系で発現しており,ELKSは脳神経系および脳以外のさまざまな組織・細胞で発現している(図2)17).CASTとELKSは比較的高い相同性を有し(約70%のアミノ酸の一致),おそらくNおよびC末端のコイルドコイル領域を介してヘテロまたはホモオリゴマーを形成すると考えられている16).CAST/ELKSには全長にわたってコイルドコイル領域が存在し,特徴的なC末端アミノ酸IWA配列を有する(図2)12, 13, 16).C末端のIWA配列は,RIM1のPDZドメインとの相互作用に必須である12, 13, 17–19).この相互作用を阻害すると,RIM1はアクティブゾーンへ局在しなくなるが,CASTの局在には影響を及ぼさないことが明らかとなった12).これは,CASTがアクティブゾーンでRIM1のアンカータンパク質として機能することを示唆している.実際に,CASTノックアウトマウスの海馬では,可溶性のRIM1が増加することも生化学的に示されている20).同様に,CAST/ELKSノックアウトマウスの網膜でも,RIMの発現量の減少が見いだされており21),CAST/ELKSファミリーはアクティブゾーンにおいてRIM1の安定性または恒常性を制御していると考えられる.
このC末端以外に,CASTには他のアクティブゾーンタンパク質に対する多くの結合領域が存在する(図2)17, 22).Bassoon, Piccolo,およびMunc13-1は,CASTの中央のコイルドコイル領域に直接結合する17, 22, 23).CAST-RIM1相互作用とは対照的に,CASTとBassoonの結合阻害は,神経終末におけるCASTとBassoonのシナプス局在に影響を与えない22).一方で,相互作用の阻害によって,培養上顎神経節ニューロンにおける興奮性シナプス後電位が大幅に減弱する22).したがって,CAST-Bassoonの結合は,互いの局在には影響を及ぼさないものの,脳内のこれらのタンパク質の生理学的機能には重要な役割を担っていることが示唆される.一方で,CAST-Piccoloの相互作用の阻害は,上顎神経節ニューロンの興奮性シナプス後電位の振幅に影響を与えないことも興味深い22).CAST-BassoonおよびCAST-Piccoloのアクティブゾーンにおける結合様式が異なっていることも考えられるが,詳細な分子メカニズムについては不明である.
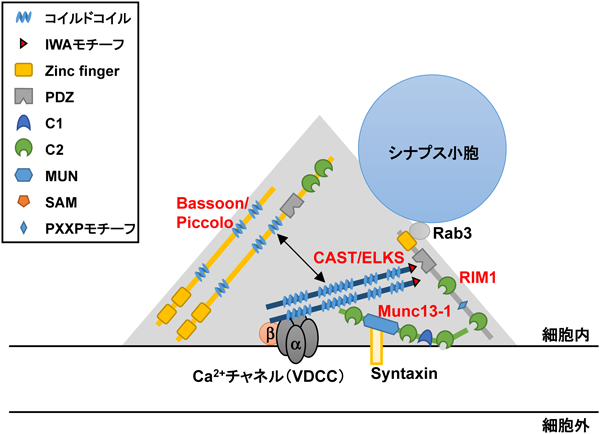
また,CAST-Munc13-1結合の生理学的意義もまだ十分な理解が進んでいない.一方で,ファミリーメンバーであるbMunc13-2はELKSのC末端領域に結合することが報告されているが,CASTには結合しない24).実際,ELKSは,培養した海馬および皮質神経細胞のプレシナプスにbMunc13-2を補充し,シナプス小胞プライミングおよび短期可塑性を制御する.したがって,異なるMunc13アイソフォーム(ここではbMunc13-2)とCASTおよびELKSとの相互作用を一つ一つ検証し,その生理的な意義を生理学的・生化学的に明らかにすることによって,CAST/ELKSファミリーとMunc13ファミリーの相互作用に関する新たな知見が得られると思われる.アクティブゾーンタンパク質間の相互作用とそれらの生理的意義に関しては,いまだに不明な点が多いものの,CAST/ELKSタンパク質ファミリーはアクティブゾーンにおいて,他のアクティブゾーンタンパク質がドッキング,プライミング,融合/開口放出などの伝達物質放出プロセスで生理学的機能を実行できるようにするための分子ハブまたはプラットフォームとして機能している可能性が示唆される(図3).
アクティブゾーンタンパク質に加えて,CASTおよびELKSには,liprin, Rab6低分子GTP結合タンパク質,LNX,および電位依存性Ca2+チャネル(VDCC)などの他の相互作用タンパク質が存在する(図2).脊椎動物には少なくとも四つのliprinαファミリーメンバー(liprinα1~4)が存在し,ショウジョウバエと線虫には一つのホモログ,liprinαとSyd-2がそれぞれ存在する25, 26).線虫のシナプス欠損変異体を見つけるための遺伝的スクリーニングにより,最初にSyd-2が同定された25).Syd-2変異動物では,アクティブゾーンの長さが野生型よりも長くなっていた.liprinαは,CAST/ELKS以外にも,白血球共通抗原関連分子(LAR),GIT1, CASK, RIM1などのいくつかのシナプス関連分子と結合する27–31).CASTとliprinαの結合は,少なくとも初代培養海馬神経細胞のシナプス成熟に関与することが示されている29).Syd-2変異体の形態学的欠損と同様に,哺乳動物のliprinはアクティブゾーンの形成において同じ,または類似の機能を有していることが示唆される.しかし,少なくとも現在の知識では,liprinノックアウトマウスのアクティブゾーンの長さが増加しているなどの形態異常を示す報告はなされていない.liprinメンバーが互いの欠損を相互に補うことができるため,ノックアウトマウスの解析だけでは,表現型を評価することは難しいかもしれない.
Rab6は低分子量GTP結合タンパク質Rabファミリーのメンバーであり,ゴルジ体から小胞体への逆行輸送や細胞輸送におけるゴルジからエンドソームへの輸送など,さまざまな種類の細胞内膜輸送を調節することが知られている32).ELKSは,フランスのGoud博士のグループによってRab6相互作用タンパク質2(Rab6IP2)として再同定され,エンドソームからゴルジ体への輸送で機能することが示された33).さらに,Rab6およびLL5βと相互作用することにより,ELKSは微小管のプラス端で動的不安定性を調節する34).また,線維芽細胞などの非神経細胞では,ELKSは細胞内の微小管の再編成,およびRab6を介した小胞の開口放出を制御している35).しかしながら,アクティブゾーンの形成・維持や神経細胞の極性形成,さらにはシナプス可塑性において,ELKS-Rab6の相互作用がいかなる役割,機能を担っているかについてはほとんど明らかになっていない.
CASTのいま一つの重要な結合タンパク質はVDCCである(図2, 3).N型,P/Q型,R型,L型などのVDCCは,アクティブゾーンでの神経伝達物質の放出に重要な役割を果たす36–39).ポア形成α1サブユニットおよびα2/δ, β, およびγ補助サブユニットは,VDCCとしてヘテロ多量体タンパク質複合体を形成する38, 40).補助サブユニットの中で,βサブユニット(β1~β4)は細胞質内でα1サブユニットと相互作用して,細胞膜への機能的チャネル輸送を促進する41, 42).次に,CASTはβサブユニット(β1~β4)と直接相互作用するが,興味深いことに,CASTは,骨格筋タイプのβ1aサブユニットと比較して,脳タイプβ4bサブユニットに対してより高い結合力を有する.BHK細胞の共発現系では,CASTは電流密度に影響を与えずに過分極方向のI-V関係を約5 mVわずかにシフトさせる43).これらのデータと一致して,Kaeser博士らのグループは,ELKSがプレシナプスのCa2+流入を増加させ,初代培養海馬神経細胞の抑制性のシナプス伝達の放出確率を高めることを報告した44).CAST/ELKS以外にも,RIM1やBassoonがVDCCと相互作用することも報告されており(表1),アクティブゾーンタンパク質群とVDCCの相互作用が,どのようにシナプス可塑性を制御して,高次機能に関与しているか,またその破綻がいかに精神神経疾患の発症につながるのかといった問題の解明が次の大きなステップと思われる.
表1 アクティブゾーンタンパク質とカルシウムチャネルの相互作用| AZタンパク質 | Ca2+チャネル | 機能,表現型 | 文献 |
|---|
| CAST | Cav2.1 | 免疫沈降実験によりCASTとCa2+チャネルの相互作用が確認された | 90) |
| VDCCβ1b |
| CAST | VDCCβ1a | CASTはP/Q型Ca2+チャネルの電位依存性の閾値を低下させる | 43) |
| VDCCβ2a |
| VDCCβ3 |
| VDCCβ4b |
| Cav2.1 |
| CAST/ELKS | 特定せず | CAST/ELKSの欠損により抑制性神経におけるCa2+流入が減少する | 44) |
| CAST/ELKS | Cav2.1 | CAST/ELKSの欠損によりCav2.1チャネルのクラスター形成が減少する | 52) |
| ELKS | VDCCβ2 | ELKSは膵臓β細胞において血管に隣接した細胞膜でCa2+流入を促進する | 56) |
| VDCCβ3 |
| RIM | Cav2.1 | RIMのPDZドメインがP/Q型のCa2+チャネルをプレシナプスへと局在させている | 91) |
| RIM | VDCCβ4b | RIM1とVDCCβ4の相互作用により神経伝達物質の放出が促進される | 92) |
| Bassoon | VDCCβ1b | 免疫沈降実験によりBassoonとCa2+チャネルの相互作用が確認された | 90) |
| VDCCβ4 | RIM結合タンパク質を介してP/Q型およびN型のCa2+チャネルの局在と機能を制御する | 93) |
| Cav2.1 | | |
| Cav2.2 | | |
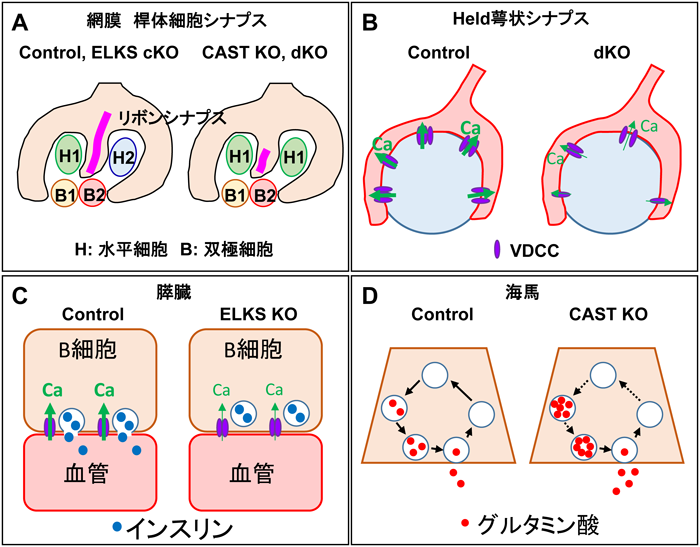
遺伝子改変マウスを用いた解析から,CASTとELKSが海馬の興奮性神経細胞と抑制性神経細胞のシナプス小胞のダイナミクスを制御することが示されている20, 44–47).Kaeser博士のグループは,CASTノックアウトマウスの電気生理学的解析により,CASTが,少なくとも抑制性シナプスにおいて,シナプス小胞の放出確率と即時放出可能プール(readily releasable pool:RRP)サイズを制限すると報告した20).CASTノックアウトマウスでは,CAST欠損を補うためにELKSの発現は増加していたが,他のアクティブゾーンタンパク質やシナプス関連タンパク質の発現に関しては大きな変化は見いだされなかった20, 46).さらに,抑制性シナプス終末でのCa2+流入は,CASTおよびELKSの条件つきダブルノックアウトマウスの神経細胞でも障害されていた44).これらのデータは,CASTおよびELKSによるシナプス小胞動態の制御が,少なくとも抑制性シナプス終末において,VDCCからのCa2+電流の調節によって実行されることを示唆している(彼らは,興奮性シナプスに異常はみられなかったと報告している).しかし,我々のグループが作製したCASTノックアウトマウスでは,CAST欠失によって興奮性シナプスで放出確率が減少し,量子サイズが増加することが明らかとなった46)(図4D).CASTノックアウトマウス海馬の研究におけるこのデータの相違は,異なるマウス系統または異なるラボでの実験条件に起因しているのかもしれない.興味深いことに,その後Kaesr博士のグループからも,CASTおよびELKSノックアウトマウスを用いた解析結果が報告され,これらが興奮性シナプスでRRPサイズを制御し,相互に補完することを示唆する報告がなされており45),現時点ではおそらく,少なくとも海馬においてはCASTおよびELKSは興奮性および抑制性シナプス伝達の両方を制御していると考えられている.この点については,すでにCAST/ELKSのfloxマウスが作製され,利用可能であるので,抑制性または興奮性神経細胞特異的にCreリコンビナーゼを発現するマウスと交配することで,より明確な答えが得られるかもしれない.
上述のように,CASTノックアウトおよびCAST/ELKSダブルノックアウトマウスでは,アクティブゾーンタンパク質の局在に顕著な変化はほとんどみられない20, 44, 46).一方で,CAST, ELKS, RIM1,およびRIM2の四つのアクティブゾーンタンパク質を同時に欠損させたノックアウトマウスは,Munc13-1, Bassoon, Piccolo,およびRIM-BP2などの他のアクティブゾーンタンパク質の発現が顕著に低下し,アクティブゾーンの電子密度も低下することが明らかとなった47).これまで,海馬などの中枢神経シナプスのアクティブゾーンの構造は,上述のアクティブゾーンタンパク質のシングルノックアウトでは,異常が報告されておらず,おそらくアクティブゾーンタンパク質どうしが相互補完しあいながらアクティブゾーンの恒常性を維持しているらしい.
前述したように,中枢とは異なり,網膜にはリボンシナプスと呼ばれる特殊なアクティブゾーンが存在する(図1).CASTノックアウトマウスの網膜では,リボンシナプスが短くなり,視細胞から双極細胞への神経伝達が減少し,個体としては視力低下などの症状を呈することが明らかになっている48).しかし,網膜リボンシナプスの形成や維持機構において,ファミリーメンバーELKSとCAST/ELKSファミリーとしての役割は最近までよくわかっていなかった.CAST/ELKSダブルノックアウトマウスでは,異所性シナプスの形成がCASTノックアウトマウスよりも顕著に増加し,視覚刺激に対する反応も低下する21).異所性シナプスの形成はELKS条件つきノックアウトではみられないが,ダブルノックアウトやCASTノックアウトマウスでは年齢とともに顕著に増加する.このような異所性シナプスの局在は夜盲症のモデルマウスをはじめとして,さまざまな視機能疾患マウスでも共通してみられる症状として知られており,CAST/ELKSダブルノックアウトマウスも夜盲症の発症メカニズムの解明や新規治療法の開発に利用できるかもしれない.さらに,最新の電子顕微鏡技術である収束イオンビーム・走査型電子顕微鏡法(FIB-SEM法)を用いた,網膜視細胞・双極細胞・水平細胞によるトライアッド構造の3次元立体再構築による解析から,CASTノックアウトおよびCAST/ELKSダブルノックアウトマウスでは水平細胞の構造異常やリボンシナプスの大幅なサイズ低下が認められ,CAST/ELKSによるシナプスの形成異常が視機能の低下に深く関与していることが示唆されている21)(図4A).一方で,成熟した網膜において後天的にELKSを欠損させると,視細胞がアポトーシスによって消失し,併せてリボンシナプスも顕著に減少する21).このように光センサーとして働く視細胞の消失は,失明や重症な視力障害を引き起こす網膜変性疾患の症状とも類似しており,視覚障害発症のメカニズム解明につながる可能性もある.しかしながら,どのような分子機序で異所性のシナプス形成やトライアッド構造の変化,さらには視細胞死が生じるのかは明らかになっていない.一つのメカニズムは伝達物質の放出異常であり,実際にこれらのマウスでは,VDCCの機能異常に伴って,視細胞終末へのCa2+の流入が顕著に阻害されている21).網膜視細胞はL型のVDCCを有し,βサブユニットも発現していることから,CAST/ELKS-VDCCの相互作用が破綻することによって,視細胞からの伝達物質の放出異常が生じ,最終的に前述の表現型につながると予想される.一方で,ELKSはシナプスにおける機能のみならず,たとえば細胞の分化や増殖などに関わるNF-κB分子群と複合体を形成することが知られており49),特に視細胞死に関してはシナプス伝達異常以外の原因も想定される.CASTの条件つき遺伝子改変マウスを用いて,ELKSと同様に急性にCASTを欠損させてその表現型を解析することで,神経伝達の異常によって視細胞死が引き起こされるかを明らかにできるかもしれない.さらに,網膜変性症に関わる多くの遺伝子が同定されており,これらの遺伝子産物がシナプスに局在するか,またそれらがCAST/ELKSと直接また間接的に相互作用しながら,シナプス伝達に関わるのかを解析していくことで,網膜変性疾患の新たな発症メカニズムが解明できるかもしれない.
これまで述べてきたように,CAST/ELKSはin vitroでVDCCと相互作用するだけでなく,海馬や網膜などin vivoでも機能的に相互作用することが明らかになりつつある.では,他の神経や組織においても同様のシステムが存在するのだろうか.
中枢の脳幹の蝸牛神経核から伸長した軸索終末端が,対側の台形体核の主細胞に形成するシナプスは,Held萼状シナプス(calyx of Held)として知られている50, 51).この神経終末は比較的大きく台形体核の主細胞を萼状に包み込み,プレ・ポスト同時にパッチクランプ解析を行うことが可能であることから,シナプス伝達,可塑性解析,さらにVDCCの動態解析のための格好のモデルとなっている51).CAST/ELKSダブルノックアウトマウスのHeld萼状シナプスでは,VDCC依存性の電流が大幅に減少するとともにVDCCの数とクラスターが顕著に低下することが明らかになった52)(図4B).さらに,シナプス小胞の放出確率と自発放出が増加する一方で,RRPサイズは低下することも見いだされている.また,アクティブゾーンの構造については顕著な変化はみられない.Held萼状シナプスにおいては,P/QタイプのVDCCと相互作用することでCAST/ELKSファミリーはシナプス伝達を制御しているらしい.
一方で,VDCCの発現レベルを制御する分子メカニズムとシナプス前終末内の分布様式はいまだよくわかっていない53).in vitroの解析から,CAST/ELKSは,VDCCのα1サブユニットのII–IIIリンカー,β4サブユニット43),およびRIMのPDZドメインに直接結合することが知られている19).さらに,RIMもまたβ4サブユニットと直接結合し,RIM1およびRIM2の欠損はプレシナプスのVDCC依存性の電流の減少をもたらす54).この表現型はCAST/ELKSの表現型と類似している.また,RIMとα1サブユニットとの相互作用はVDCCの発現レベルの調節に必須ではないことから53),これらの知見を総合すると,おそらくRIMとCAST/ELKSがともにβ4サブユニットを介してα1サブユニットを含む巨大なタンパク質複合体を形成し,これが間接的もしくは直接的にアクティブゾーンにおけるVDCCの量を制御している可能性が想定できる.
それでは,脳神経系以外ではどうだろうか.これまで我々は杏林大学・今泉博士との共同研究で,ELKSが膵臓のβ細胞に発現していることを見いだしていた55).この成果をもとに,最近,膵臓のβ細胞特異的なELKS欠損マウスの作出に成功し,インスリン分泌における役割を個体レベルで解析した56).膵β細胞特異的ELKSノックアウトマウスでは,糖負荷試験による耐糖能異常に加え,グルコースに対するインスリン分泌の顕著な低下,グルコース刺激に対する細胞内Ca2+上昇応答の低下などが見いだされた56).さらに電気生理学的解析から,ELKS KOのβ細胞ではL型のVDCCのCa2+電流が顕著に低下し,過剰発現のデータからはELKSがL型のVDCCの開口を促進していることが示唆されている(図4C).
さらに,Ca2+センサー・G-CaMP8bをβ細胞膜に発現させて,膵島内β細胞膜直下のCa2+イメージング解析を行ったところ,グルコース刺激によるCa2+上昇は毛細血管側のβ細胞膜で最初に出現するが,ELKSノックアウトマウスのβ細胞ではそのCa2+上昇が減少し,毛細血管側のβ細胞膜で最初に出現するような極性を持ったパターンが消失することを見いだした(図4C)56).
おそらく,毛細血管側のβ細胞膜に局在しているELKSがL型のVDCCと複合体を形成し,毛細血管側のβ細胞膜でグルコース刺激によって直ちに引き起こされるCa2+流入を促進させ,インスリンを効率よく血管方向へ分泌させていると考えられる.これまでのところ,糖尿病発症の原因遺伝子としてELKSの変異や一塩基多型(SNP)の報告はないが,2型糖尿病モデルマウスであるdb/dbマウスの膵島ではELKSの発現量が低下していることから56),ヒトの糖尿病でも臨床検体を用いたオミックス解析などを進めることで,ELKSが関与する病態が明らかになるかもしれない.
このように,CAST/ELKS-VDCCの相互作用システムは神経系のみならず,末梢の分泌系細胞においても保存され,重要な役割を担っていると考えられる.実際に,ELKSは,副腎髄質由来の細胞株であるPC12細胞において成長因子の放出を制御し57),マスト細胞系RBL-2H細胞においてはヒスタミンの放出に関与する58).これらの系においても,細胞内のCa2+の上昇に伴った小胞の融合,脱顆粒が生じることから,ELKSとカルシウムシグナルとの相互作用が機能していると考えられる.このシステムはショウジョウバエにおいても保存されており,CAST/ELKSのハエのホモログであるBruchpilotを欠損させるとアクティブゾーンが消失し,VDCCも局在が変化する59, 60).したがって,CAST/ELKS-VDCCシステムは種を超えて保存されている普遍的な分泌制御マシナリーと考えられる.
6. CAST/ELKSファミリーのリン酸化による機能調節機構
本節では主にリン酸化によるCAST/ELKSの機能制御について概説する.我々は,プレシナプスに局在する機能分子をスクリーニングする過程で,SAD-1キナーゼの哺乳類ホモログであるSAD-AおよびSAD-Bを分離・同定することに成功した61).SAD-1は,もともと,線虫のシナプス機能に異常を生じる変異体を単離するための遺伝的スクリーニングによって同定されていた62).一方で,我々の報告以前に,SAD-AおよびSAD-Bのダブルノックアウトマウスの解析から,初期の神経発生過程では,SADは軸索/樹状突起の極性を調節することが明らかになっていた63).SADファミリー個々のノックアウトマウスでは表現型が出ないことから,神経細胞の樹状突起形成にはSAD-AおよびSAD-Bの両分子が必要となるようである.これは単一遺伝子ファミリーを欠損させることで,神経細胞の極性形成が個体レベルで阻害された最初の報告で,きわめて大きなインパクトがあった.我々は,神経の初期発生ではなく,成熟した脳におけるSADの局在と機能に着目していた.まず電子顕微鏡による解析から,成熟した脳ではSAD-Bはシナプス小胞とアクティブゾーンに特異的に局在することが明らかとなった61).また,末梢では神経筋接合部のプレシナプスに局在する64).一般的に,細胞内のリン酸化酵素は細胞質にdiffuseに局在するものが多いが,このような特徴的な局在を示すリン酸化酵素は現在でもSAD以外には知られていない.また,SADがどのようにして,強くアクティブゾーンに結合しているのかもまったくわかっていない.SAD-Bは,その局在と一致するように,少なくともin vitroでアクティブゾーンタンパク質RIM1をリン酸化するが,その特異的にリン酸化されるセリンまたはトレオニン残基は同定されていない61).SAD-Bノックアウトマウスを用いた解析から,SAD-Bはプレシナプスでのシナプス小胞の放出確率を制御し,RRPサイズの調節に関与していることが明らかとなった65).さらに,SAD-Bノックアウトマウスは,海馬依存性の文脈的恐怖学習の障害を示す65).これらの発見は,SAD-Bが脳内のシナプス小胞の動態と海馬機能の調節に重要な役割を果たすことを示唆する.
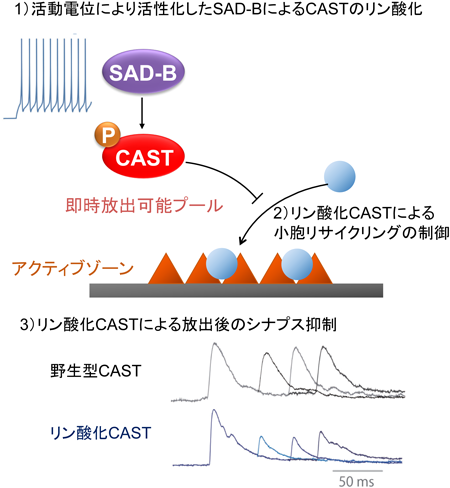
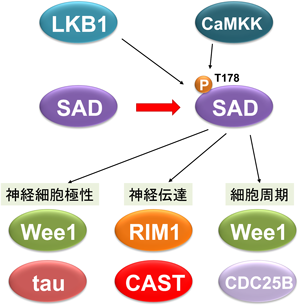
SAD-Bは,RIM1以外に,CASTを直接リン酸化する66).実際に,CASTの45番目のセリン残基が特異的にリン酸化される.抗リン酸化CAST抗体を用いたマウス脳の免疫染色では,CASTが強く発現している海馬において,リン酸化CASTのシグナルが検出されることからin vivoでもCASTがリン酸化されていることが明らかになっている.CASTのリン酸化はアクティブゾーンへの小胞の補充を抑制し,RRPでのシナプス小胞数を減少させ,プレシナプス特有の可塑性であるシナプス短期抑圧を増強する(図5).また,shRNA法(RNA干渉法)によるCASTのノックダウンも同様に,RRPへの小胞補充を抑え伝達物質放出を抑制する.これらの結果から,活動電位が高頻度に発生して神経活動が活発であるときには,CASTがリン酸化され,伝達物質放出部位へのシナプス小胞の補充をブロックすることで一時的にシナプス伝達を抑制していると考えられる(図5).リン酸化されたCASTは神経伝達物質の過剰な放出に“ブレーキ”をかけ,伝達物質放出と可塑性を制御している.現在,SADを活性化する上流のシグナル経路についてはLKB1およびCaMKKの2種類のリン酸化酵素が知られている67, 68).さらに,これらもしくは未知の上流因子によって活性化されたSADは,RIM1やCAST以外にも,Wee1やTau63, 69, 70)をリン酸化して,神経細胞極性や細胞周期などさまざまな細胞生理機能を担っている(図6).今後も,リン酸化プロテオミクスを中心とした生化学的・分子生物学的アプローチによって,SADの上流と下流シグナルの全貌とそれらの生理機能が分子レベルで明らかになることを期待したい.
一方で,リン酸化されたCASTや他のアクティブゾーンタンパク質がタンパク質ホスファターゼによって脱リン酸化されるかどうか,その作用機構を見いだすことは非常に興味深い.たとえば,セリン・トレオニンホスファターゼではないが,LARファミリー受容体タンパク質ホスファターゼ(LAR-RPTP)は,軸索ガイダンスおよび興奮性シナプスの維持に関係するチロシンホスファターゼの一つである71, 72).特に,LAR-RPTPは線虫において,前述のCAST結合タンパク質でもあるliprinα(SYD-2としても知られている)73, 74)に直接結合する25).しかし,LAR-RPTP-liprin系が哺乳動物のアクティブゾーンで機能しているかは,現在においても,明らかになっていない.もちろん将来的にCASTのチロシンリン酸化部位が同定されれば,LAR-RPTPによるCASTのリン酸化/脱リン酸化のメカニズムが明らかになる可能性がある.これまでに多くのタンパク質ホスファターゼが同定され解析されてきており75–77),将来的には,CASTを含めたアクティブゾーンタンパク質のリン酸化・脱リン酸化の機序が明らかとなるであろう.そして,たとえば,そのリン酸化のオンオフを自在に操作できるような介入実験系を確立することで,シナプス形成や可塑性を自在に操作する新たなツール開発が実現できるかもしれない.
この30年来の研究によってアクティブゾーンを構成する分子群が同定され,その分子構造基盤の解明が進んできた.しかしながら,CAST/ELKSに関してもいまだにいくつかの未解決の問題が存在する.たとえば,CASTとELKSはどのような分子メカニズムでアクティブゾーンに局在するのであろうか.CAST/ELKSは膜貫通領域を有していないので,直接プレシナプス形質膜に結合しているか,何らかの分子を介して間接的にアクティブゾーンに局在している可能性がある.おそらく,プレシナプスに存在するチャネルや接着分子の細胞内領域と強固に結合している可能性が高いと考えられているものの,CAST/ELKSと直接結合する膜貫通型タンパク質はいまだ同定されていない.アクティブゾーンに存在するCASTは,タンパク質間相互作用を保持するTriton X-100やNP-40などの界面活性剤では可溶化できないので,古典的な生化学的アプローチではCAST結合タンパク質(膜タンパク質)を見つけることは難しい.一方で,ファミリーメンバーELKSはCASTよりも可溶化されやすいので16),網羅的に同定したELKS結合タンパク質のなかからCAST結合タンパク質を見つけ出す方法も一つの試みかもしれない.
2002年までに,RIM, Munc13-1, Bassoon, Piccolo, ELKS, CASTといった六つのアクティブゾーンタンパク質が同定されたが,それ以降は発見されていない.一方で,図1に示すように多様なシナプスが多様なアクティブゾーンを有していることから,コアになる六つのアクティブゾーンタンパク質に結合する分子がアクティブゾーンごとに異なっていて,その複合体の多様性がアクティブゾーンの構造の多様性を生み出しているのではないだろうか.アクティブゾーン関連タンパク質のさらなる同定が進み,超解像顕微鏡やクライオ電子顕微鏡なども組み合わせることで,近い将来,アクティブゾーンの分子構造基盤の全容解明がなされることを期待したい.
引用文献References
1) Südhof, T.C. (1995) The synaptic vesicle cycle: a cascade of protein-protein interactions. Nature, 375, 645–653.
2) Mochida, S. (2011) Activity-dependent regulation of synaptic vesicle exocytosis and presynaptic short-term plasticity. Neurosci. Res., 70, 16–23.
3) Petzoldt, A.G., Lützkendorf, J., & Sigrist, S.J. (2016) Mechanisms controlling assembly and plasticity of presynaptic active zone scaffolds. Curr. Opin. Neurobiol., 39, 69–76.
4) Couteaux, R. & Pecot-Dechavassine, M. (1970) Synaptic vesicles and pouches at the level of “active zones” of the neuromuscular junction. C. R. Acad. Sci. Hebd. Seances Acad. Sci. D, 271, 2346–2349.
5) Landis, D.M., Hall, A.K., Weinstein, L.A., & Reese, T.S. (1988) The organization of cytoplasm at the presynaptic active zone of a central nervous system synapse. Neuron, 1, 201–209.
6) Zhai, R.G. & Bellen, H.J. (2004) The architecture of the active zone in the presynaptic nerve terminal. Physiology (Bethesda), 19, 262–270.
7) Brose, N., Hofmann, K., Hata, Y., & Südhof, T.C. (1995) Mammalian homologues of Caenorhabditis elegans unc-13 gene define novel family of C2-domain proteins. J. Biol. Chem., 270, 25273–25280.
8) Wang, Y., Okamoto, M., Schmitz, F., Hofmann, K., & Südhof, T.C. (1997) Rim is a putative Rab3 effector in regulating synaptic-vesicle fusion. Nature, 388, 593–598.
9) Cases-Langhoff, C., Voss, B., Garner, A.M., Appeltauer, U., Takei, K., Kindler, S., Veh, R.W., De Camilli, P., Gundelfinger, E.D., & Garner, C.C. (1996) Piccolo, a novel 420 kDa protein associated with the presynaptic cytomatrix. Eur. J. Cell Biol., 69, 214–223.
10) tom Dieck, S., Sanmartí-Vila, L., Langnaese, K., Richter, K., Kindler, S., Soyke, A., Wex, H., Smalla, K.H., Kämpf, U., Fränzer, J.T., et al. (1998) Bassoon, a novel zinc-finger CAG/glutamine-repeat protein selectively localized at the active zone of presynaptic nerve terminals. J. Cell Biol., 142, 499–509.
11) Fenster, S.D., Chung, W.J., Zhai, R., Cases-Langhoff, C., Voss, B., Garner, A.M., Kaempf, U., Kindler, S., Gundelfinger, E.D., & Garner, C.C. (2000) Piccolo, a presynaptic zinc finger protein structurally related to bassoon. Neuron, 25, 203–214.
12) Ohtsuka, T., Takao-Rikitsu, E., Inoue, E., Inoue, M., Takeuchi, M., Matsubara, K., Deguchi-Tawarada, M., Satoh, K., Morimoto, K., Nakanishi, H., et al. (2002) Cast: a novel protein of the cytomatrix at the active zone of synapses that forms a ternary complex with RIM1 and munc13-1. J. Cell Biol., 158, 577–590.
13) Wang, Y., Liu, X., Biederer, T., & Südhof, T.C. (2002) A family of RIM-binding proteins regulated by alternative splicing: Implications for the genesis of synaptic active zones. Proc. Natl. Acad. Sci. USA, 99, 14464–14469.
14) Ackermann, F., Waites, C.L., & Garner, C.C. (2015) Presynaptic active zones in invertebrates and vertebrates. EMBO Rep., 16, 923–938.
15) Nakata, T., Kitamura, Y., Shimizu, K., Tanaka, S., Fujimori, M., Yokoyama, S., Ito, K., & Emi, M. (1999) Fusion of a novel gene, ELKS, to RET due to translocation t(10;12)(q11;p13) in a papillary thyroid carcinoma. Genes Chromosomes Cancer, 25, 97–103.
16) Deguchi-Tawarada, M., Inoue, E., Takao-Rikitsu, E., Inoue, M., Ohtsuka, T., & Takai, Y. (2004) CAST2: identification and characterization of a protein structurally related to the presynaptic cytomatrix protein CAST. Genes Cells, 9, 15–23.
17) Hida, Y. & Ohtsuka, T. (2010) CAST and ELKS proteins: structural and functional determinants of the presynaptic active zone. J. Biochem., 148, 131–137.
18) Deken, S.L., Vincent, R., Hadwiger, G., Liu, Q., Wang, Z.W., & Nonet, M.L. (2005) Redundant localization mechanisms of RIM and ELKS in Caenorhabditis elegans. J. Neurosci., 25, 5975–5983.
19) Lu, J., Li, H., Wang, Y., Südhof, T.C., & Rizo, J. (2005) Solution structure of the RIM1alpha PDZ domain in complex with an ELKS1b C-terminal peptide. J. Mol. Biol., 352, 455–466.
20) Kaeser, P.S., Deng, L., Chavez, A.E., Liu, X., Castillo, P.E., & Südhof, T.C. (2009) ELKS2alpha/CAST deletion selectively increases neurotransmitter release at inhibitory synapses. Neuron, 64, 227–239.
21) Hagiwara, A., Kitahara, Y., Grabner, C.P., Vogl, C., Abe, M., Kitta, R., Ohta, K., Nakamura, K., Sakimura, K., Moser, T., et al. (2018) Cytomatrix proteins CAST and ELKS regulate retinal photoreceptor development and maintenance. J. Cell Biol., 217, 3993–4006.
22) Takao-Rikitsu, E., Mochida, S., Inoue, E., Deguchi-Tawarada, M., Inoue, M., Ohtsuka, T., & Takai, Y. (2004) Physical and functional interaction of the active zone proteins, CAST, RIM1, and Bassoon, in neurotransmitter release. J. Cell Biol., 164, 301–311.
23) Wang, X., Hu, B., Zieba, A., Neumann, N.G., Kasper-Sonnenberg, M., Honsbein, A., Hultqvist, G., Conze, T., Witt, W., Limbach, C., et al. (2009) A protein interaction node at the neurotransmitter release site: domains of Aczonin/Piccolo, Bassoon, CAST, and rim converge on the N-terminal domain of Munc13-1. J. Neurosci., 29, 12584–12596.
24) Kawabe, H., Mitkovski, M., Kaeser, P.S., Hirrlinger, J., Opazo, F., Nestvogel, D., Kalla, S., Fejtova, A., Verrier, S.E., Bungers, S.R., et al. (2017) ELKS1 localizes the synaptic vesicle priming protein bMunc13-2 to a specific subset of active zones. J. Cell Biol., 216, 1143–1161.
25) Zhen, M. & Jin, Y. (1999) The liprin protein SYD-2 regulates the differentiation of presynaptic termini in C. elegans. Nature, 401, 371–375.
26) Dai, Y., Taru, H., Deken, S.L., Grill, B., Ackley, B., Nonet, M.L., & Jin, Y. (2006) SYD-2 Liprin-alpha organizes presynaptic active zone formation through ELKS. Nat. Neurosci., 9, 1479–1487.
27) Schoch, S., Castillo, P.E., Jo, T., Mukherjee, K., Geppert, M., Wang, Y., Schmitz, F., Malenka, R.C., & Südhof, T.C. (2002) RIM1alpha forms a protein scaffold for regulating neurotransmitter release at the active zone. Nature, 415, 321–326.
28) Ko, J., Kim, S., Valtschanoff, J.G., Shin, H., Lee, J.R., Sheng, M., Premont, R.T., Weinberg, R.J., & Kim, E. (2003a) Interaction between liprin-alpha and GIT1 is required for AMPA receptor targeting. J. Neurosci., 23, 1667–1677.
29) Ko, J., Na, M., Kim, S., Lee, J.R., & Kim, E. (2003b) Interaction of the ERC family of RIM-binding proteins with the liprin-alpha family of multidomain proteins. J. Biol. Chem., 278, 42377–42385.
30) Olsen, O., Moore, K.A., Fukata, M., Kazuta, T., Trinidad, J.C., Kauer, F.W., Streuli, M., Misawa, H., Burlingame, A.L., Nicoll, R.A., et al. (2005) Neurotransmitter release regulated by a MALS-liprin-alpha presynaptic complex. J. Cell Biol., 170, 1127–1134.
31) Stryker, E. & Johnson, K.G. (2007) LAR, liprin alpha and the regulation of active zone morphogenesis. J. Cell Sci., 120, 3723–3728.
32) Grosshans, B.L., Ortiz, D., & Novick, P. (2006) Rabs and their effectors: achieving specificity in membrane traffic. Proc. Natl. Acad. Sci. USA, 103, 11821–11827.
33) Monier, S., Jollivet, F., Janoueix-Lerosey, I., Johannes, L., & Goud, B. (2002) Characterization of novel Rab6-interacting proteins involved in endosome-to-TGN transport. Traffic, 3, 289–297.
34) Lansbergen, G., Grigoriev, I., Mimori-Kiyosue, Y., Ohtsuka, T., Higa, S., Kitajima, I., Demmers, J., Galjart, N., Houtsmuller, A.B., Grosveld, F., et al. (2006) CLASPs attach microtubule plus ends to the cell cortex through a complex with LL5beta. Dev. Cell, 11, 21–32.
35) Grigoriev, I., Splinter, D., Keijzer, N., Wulf, P.S., Demmers, J., Ohtsuka, T., Modesti, M., Maly, I.V., Grosveld, F., Hoogenraad, C.C., et al. (2007) Rab6 regulates transport and targeting of exocytotic carriers. Dev. Cell, 13, 305–314.
36) Takahashi, T. & Momiyama, A. (1993) Different types of calcium channels mediate central synaptic transmission. Nature, 366, 156–158.
37) Wheeler, D.B., Randall, A., & Tsien, R.W. (1994) Roles of N-type and Q-type Ca2+ channels in supporting hippocampal synaptic transmission. Science, 264, 107–111.
38) Catterall, W.A., Perez-Reyes, E., Snutch, T.P., & Striessnig, J. (2005) International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels. Pharmacol. Rev., 57, 411–425.
39) Wu, L.G., Westenbroek, R.E., Borst, J.G., Catterall, W.A., & Sakmann, B. (1999) Calcium channel types with distinct presynaptic localization couple differentially to transmitter release in single calyx-type synapses. J. Neurosci., 19, 726–736.
40) Ertel, E.A., Campbell, K.P., Harpold, M.M., Hofmann, F., Mori, Y., Perez-Reyes, E., Schwartz, A., Snutch, T.P., Tanabe, T., Birnbaumer, L., et al. (2000) Nomenclature of voltage-gated calcium channels. Neuron, 25, 533–535.
41) Mori, Y., Friedrich, T., Kim, M.S., Mikami, A., Nakai, J., Ruth, P., Bosse, E., Hofmann, F., Flockerzi, V., Furuichi, T., et al. (1991) Primary structure and functional expression from complementary DNA of a brain calcium channel. Nature, 350, 398–402.
42) Bichet, D., Cornet, V., Geib, S., Carlier, E., Volsen, S., Hoshi, T., Mori, Y., & De Waard, M. (2000) The I-II loop of the Ca2+ channel alpha1 subunit contains an endoplasmic reticulum retention signal antagonized by the beta subunit. Neuron, 25, 177–190.
43) Kiyonaka, S., Nakajima, H., Takada, Y., Hida, Y., Yoshioka, T., Hagiwara, A., Kitajima, I., Mori, Y., & Ohtsuka, T. (2012) Physical and functional interaction of the active zone protein CAST/ERC2 and the β-subunit of the voltage-dependent Ca(2+) channel. J. Biochem., 152, 149–159.
44) Liu, C., Bickford, L.S., Held, R.G., Nyitrai, H., Südhof, T.C., & Kaeser, P.S. (2014) The active zone protein family ELKS supports Ca2+ influx at nerve terminals of inhibitory hippocampal neurons. J. Neurosci., 34, 12289–12303.
45) Held, R.G., Liu, C., & Kaeser, P.S. (2016). eLife, 5, e14862.
46) Kobayashi, S., Hida, Y., Ishizaki, H., Inoue, E., Tanaka-Okamoto, M., Yamasaki, M., Miyazaki, T., Fukaya, M., Kitajima, I., Takai, Y., et al. (2016) The active zone protein CAST regulates synaptic vesicle recycling and quantal size in the mouse hippocampus. Eur. J. Neurosci., 44, 2272–2284.
47) Wang, S.S.H., Held, R.G., Wong, M.Y., Liu, C., Karakhanyan, A., & Kaeser, P.S. (2016) Fusion Competent Synaptic Vesicles Persist upon Active Zone Disruption and Loss of Vesicle Docking. Neuron, 91, 777–791.
48) Tom Dieck, S., Specht, D., Strenzke, N., Hida, Y., Krishnamoorthy, V., Schmidt, K.F., Inoue, E., Ishizaki, H., Tanaka-Okamoto, M., Miyoshi, J., et al. (2012) Deletion of the presynaptic scaffold CAST reduces active zone size in rod photoreceptors and impairs visual processing. J. Neurosci., 32, 12192–12203.
49) Wu, Z.H., Wong, E.T., Shi, Y., Niu, J., Chen, Z., Miyamoto, S., & Tergaonkar, V. (2010) ATM- and NEMO-dependent ELKS ubiquitination coordinates TAK1-mediated IKK activation in response to genotoxic stress. Mol. Cell, 40, 75–86.
50) Neher, E. (2017) Some Subtle Lessons from the Calyx of Held Synapse. Biophys. J., 112, 215–223.
51) Borst, J.G. & Soria van Hoeve, J. (2012) The calyx of Held synapse: from model synapse to auditory relay. Annu. Rev. Physiol., 74, 199–224.
52) Dong, W., Radulovic, T., Goral, R.O., Thomas, C., Suarez Montesinos, M., Guerrero-Given, D., Hagiwara, A., Putzke, T., Hida, Y., Abe, M., et al. (2018) CAST/ELKS Proteins Control Voltage-Gated Ca2+ Channel Density and Synaptic Release Probability at a Mammalian Central Synapse. Cell Rep., 24, 284–293.e6.
53) Lubbert, M., Goral, R.O., Satterfield, R., Putzke, T., van den Maagdenberg, A.M., Kamasawa, N., & Young, S.M. Jr. (2017). eLife, 6, e28412.
54) Han, Y., Kaeser, P.S., Südhof, T.C., & Schneggenburger, R. (2011) RIM determines Ca2+ channel density and vesicle docking at the presynaptic active zone. Neuron, 69, 304–316.
55) Ohara-Imaizumi, M., Ohtsuka, T., Matsushima, S., Akimoto, Y., Nishiwaki, C., Nakamichi, Y., Kikuta, T., Nagai, S., Kawakami, H., Watanabe, T., et al. (2005) ELKS, a protein structurally related to the active zone-associated protein CAST, is expressed in pancreatic beta cells and functions in insulin exocytosis: interaction of ELKS with exocytotic machinery analyzed by total internal reflection fluorescence microscopy. Mol. Biol. Cell, 16, 3289–3300.
56) Ohara-Imaizumi, M., Aoyagi, K., Hida, Y., Yoshida, M., Yamauchi, H., Ohkura, M., Abe, M., Akimoto, Y., Nakamichi, Y., Nishiwaki, C., et al. (2019) ELKS/Voltage-Dependent Ca2+ Channel-β Subunit Module Regulates Polarized Ca2+ Influx in Pancreatic β Cells. Cell Rep., 26, 1213–1226.e7.
57) Inoue, E., Deguchi-Tawarada, M., Takao-Rikitsu, E., Inoue, M., Kitajima, I., Ohtsuka, T., & Takai, Y. (2006a) ELKS, a protein structurally related to the active zone protein CAST, is involved in Ca2+-dependent exocytosis from PC12 cells. Genes Cells, 11, 659–672.
58) Nomura, H., Ohtsuka, T., Tadokoro, S., Tanaka, M., & Hirashima, N. (2009) Involvement of ELKS, an active zone protein, in exocytotic release from RBL-2H3 cells. Cell. Immunol., 258, 204–211.
59) Kittel, R.J., Wichmann, C., Rasse, T.M., Fouquet, W., Schmidt, M., Schmid, A., Wagh, D.A., Pawlu, C., Kellner, R.R., Willig, K.I., et al. (2006) Bruchpilot promotes active zone assembly, Ca2+ channel clustering, and vesicle release. Science, 312, 1051–1054.
60) Wagh, D.A., Rasse, T.M., Asan, E., Hofbauer, A., Schwenkert, I., Dürrbeck, H., Buchner, S., Dabauvalle, M.C., Schmidt, M., Qin, G., et al. (2006) Bruchpilot, a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron, 49, 833–844.
61) Inoue, E., Mochida, S., Takagi, H., Higa, S., Deguchi-Tawarada, M., Takao-Rikitsu, E., Inoue, M., Yao, I., Takeuchi, K., Kitajima, I., et al. (2006b) SAD: a presynaptic kinase associated with synaptic vesicles and the active zone cytomatrix that regulates neurotransmitter release. Neuron, 50, 261–275.
62) Crump, J.G., Zhen, M., Jin, Y., & Bargmann, C.I. (2001) The SAD-1 kinase regulates presynaptic vesicle clustering and axon termination. Neuron, 29, 115–129.
63) Kishi, M., Pan, Y.A., Crump, J.G., & Sanes, J.R. (2005) Mammalian SAD kinases are required for neuronal polarization. Science, 307, 929–932.
64) Hagiwara, A., Harada, K., Hida, Y., Kitajima, I., & Ohtsuka, T. (2011) Distribution of serine/threonine kinase SAD-B in mouse peripheral nerve synapse. Neuroreport, 22, 319–325.
65) Watabe, A.M., Nagase, M., Hagiwara, A., Hida, Y., Tsuji, M., Ochiai, T., Kato, F., & Ohtsuka, T. (2016) SAD-B kinase regulates pre-synaptic vesicular dynamics at hippocampal Schaffer collateral synapses and affects contextual fear memory. J. Neurochem., 136, 36–47.
66) Mochida, S., Hida, Y., Tanifuji, S., Hagiwara, A., Hamada, S., Abe, M., Ma, H., Yasumura, M., Kitajima, I., Sakimura, K., et al. (2016) SAD-B Phosphorylation of CAST Controls Active Zone Vesicle Recycling for Synaptic Depression. Cell Rep., 16, 2901–2913.
67) Barnes, A.P., Lilley, B.N., Pan, Y.A., Plummer, L.J., Powell, A.W., Raines, A.N., Sanes, J.R., & Polleux, F. (2007) LKB1 and SAD kinases define a pathway required for the polarization of cortical neurons. Cell, 129, 549–563.
68) Fujimoto, T., Yurimoto, S., Hatano, N., Nozaki, N., Sueyoshi, N., Kameshita, I., Mizutani, A., Mikoshiba, K., Kobayashi, R., & Tokumitsu, H. (2008) Activation of SAD kinase by Ca2+/calmodulin-dependent protein kinase kinase. Biochemistry, 47, 4151–4159.
69) Müller, M., Lutter, D., & Püschel, A.W. (2010) Persistence of the cell-cycle checkpoint kinase Wee1 in SadA- and SadB-deficient neurons disrupts neuronal polarity. J. Cell Sci., 123, 286–294.
70) Lu, R., Niida, H., & Nakanishi, M. (2004) Human SAD1 kinase is involved in UV-induced DNA damage checkpoint function. J. Biol. Chem., 279, 31164–31170.
71) Johnson, K.G. & Van Vactor, D. (2003) Receptor protein tyrosine phosphatases in nervous system development. Physiol. Rev., 83, 1–24.
72) Dunah, A.W., Hueske, E., Wyszynski, M., Hoogenraad, C.C., Jaworski, J., Pak, D.T., Simonetta, A., Liu, G., & Sheng, M. (2005) LAR receptor protein tyrosine phosphatases in the development and maintenance of excitatory synapses. Nat. Neurosci., 8, 458–467.
73) Serra-Pages, C., Kedersha, N.L., Fazikas, L., Medley, Q., Debant, A., & Streuli, M. (1995) The LAR transmembrane protein tyrosine phosphatase and a coiled-coil LAR-interacting protein co-localize at focal adhesions. EMBO J., 14, 2827–2838.
74) Serra-Pages, C., Medley, Q.G., Tang, M., Hart, A., & Streuli, M. (1998) Liprins, a family of LAR transmembrane protein-tyrosine phosphatase-interacting proteins. J. Biol. Chem., 273, 15611–15620.
75) Alonso, A., Sasin, J., Bottini, N., Friedberg, I., Osterman, A., Godzik, A., Hunter, T., Dixon, J., & Mustelin, T. (2004) Protein tyrosine phosphatases in the human genome. Cell, 117, 699–711.
76) Shi, Y. (2009) Serine/threonine phosphatases: mechanism through structure. Cell, 139, 468–484.
77) Sacco, F., Perfetto, L., Castagnoli, L., & Cesareni, G. (2012) The human phosphatase interactome: An intricate family portrait. FEBS Lett., 586, 2732–2739.
78) Hashida, H., Goto, J., Zhao, N., Takahashi, N., Hirai, M., Kanazawa, I., & Sakaki, Y. (1998) Cloning and mapping of ZNF231, a novel brain-specific gene encoding neuronal double zinc finger protein whose expression is enhanced in a neurodegenerative disorder, multiple system atrophy (MSA). Genomics, 54, 50–58.
79) van Es, M.A., Veldink, J.H., Saris, C.G.J., Blauw, H.M., van Vught, P.W.J., Birve, A., Lemmens, R., Schelhaas, H.J., Groen, E.J.N., Huisman, M.H.B., et al. (2009) Genome-wide association study identifies 19p13.3 (UNC13A) and 9p21.2 as susceptibility loci for sporadic amyotrophic lateral sclerosis. Nat. Genet., 41, 1083–1088.
80) Johnson, S., Halford, S., Morris, A.G., Patel, R.J., Wilkie, S.E., Hardcastle, A.J., Moore, A.T., Zhang, K., & Hunt, D.M. (2003) Genomic organisation and alternative splicing of human RIM1, a gene implicated in autosomal dominant cone-rod dystrophy (CORD7). Genomics, 81, 304–314.
81) Tabuchi, K., Blundell, J., Etherton, M.R., Hammer, R.E., Liu, X., Powell, C.M., & Südhof, T.C. (2007) A neuroligin-3 mutation implicated in autism increases inhibitory synaptic transmission in mice. Science, 318, 71–76.
82) Anderson, G.R., Galfin, T., Xu, W., Aoto, J., Malenka, R.C., & Südhof, T.C. (2012) Candidate autism gene screen identifies critical role for cell-adhesion molecule CASPR2 in dendritic arborization and spine development. Proc. Natl. Acad. Sci. USA, 109, 18120–18125.
83) Bacaj, T., Ahmad, M., Jurado, S., Malenka, R.C., & Südhof, T.C. (2015) Synaptic Function of Rab11Fip5: Selective Requirement for Hippocampal Long-Term Depression. J. Neurosci., 35, 7460–7474.
84) Pak, C., Danko, T., Zhang, Y., Aoto, J., Anderson, G., Maxeiner, S., Yi, F., Wernig, M., & Südhof, T.C. (2015) Human Neuropsychiatric Disease Modeling using Conditional Deletion Reveals Synaptic Transmission Defects Caused by Heterozygous Mutations in NRXN1. Cell Stem Cell, 17, 316–328.
85) Yi, F., Danko, T., Botelho, S.C., Patzke, C., Pak, C., Wernig, M., & Südhof, T.C. (2016) Autism-associated SHANK3 haploinsufficiency causes Ih channelopathy in human neurons. Science, 352, aaf2669.
86) Lipstein, N., Verhoeven-Duif, N.M., Michelassi, F.E., Calloway, N., van Hasselt, P.M., Pienkowska, K., van Haaften, G., van Haelst, M.M., van Empelen, R., Cuppen, I., et al. (2017) Synaptic UNC13A protein variant causes increased neurotransmission and dyskinetic movement disorder. J. Clin. Invest., 127, 1005–1018.
87) Michelassi, F., Liu, H., Hu, Z., & Dittman, J.S. (2017) A C1-C2 Module in Munc13 Inhibits Calcium-Dependent Neurotransmitter Release. Neuron, 95, 577–590.
88) Thevenon, J., Callier, P., Andrieux, J., Delobel, B., David, A., Sukno, S., Minot, D., Mosca Anne, L., Marle, N., Sanlaville, D., et al. (2012) 12p13.33 microdeletion including ELKS/ERC1, a new locus associated with childhood apraxia of speech. Eur. J. Hum. Genet., 21, 82–88.
89) Silva, I.M., Rosenfeld, J., Antoniuk, S.A., Raskin, S., & Sotomaior, V.S. (2014) A 1.5Mb terminal deletion of 12p associated with autism spectrum disorder. Gene, 542, 83–86.
90) Chen, J., Billings, S.E., & Nishimune, H. (2011) Calcium channels link the muscle-derived synapse organizer laminin β2 to Bassoon and CAST/Erc2 to organize presynaptic active zones. J. Neurosci., 31, 512–525.
91) Kaeser, P.S., Deng, L., Wang, Y., Dulubova, I., Liu, X., Rizo, J., & Südhof, T.C. (2011) RIM proteins tether Ca2+ channels to presynaptic active zones via a direct PDZ-domain interaction. Cell, 144, 282–295.
92) Kiyonaka, S., Wakamori, M., Miki, T., Uriu, Y., Nonaka, M., Bito, H., Beedle, A.M., Mori, E., Hara, Y., De Waard, M., et al. (2007) RIM1 confers sustained activity and neurotransmitter vesicle anchoring to presynaptic Ca2+ channels. Nat. Neurosci., 10, 691–701.
93) Davydova, D., Marini, C., King, C., Klueva, J., Bischof, F., Romorini, S., Montenegro-Venegas, C., Heine, M., Schneider, R., Schröder, M.S., et al. (2014) Bassoon specifically controls presynaptic P/Q-type Ca(2+) channels via RIM-binding protein. Neuron, 82, 181–194.