ペリサイトは,形態学的に組織の微小血管を被覆する細胞であると定義される.ペリサイトは,100年以上前にフランスの生理学者Rougetにより発見され,当時はRouget cellと呼ばれていた.1923年にZimmermannによって微小血管周囲の特異的な形態を示す細胞として再発見され,「ペリサイト」という名前とともに世に広く知られるようになった.しかしながら,2000年代に入るまでは,ペリサイトの血管機能における役割について不明な点が多く,謎に包まれた細胞であった1).
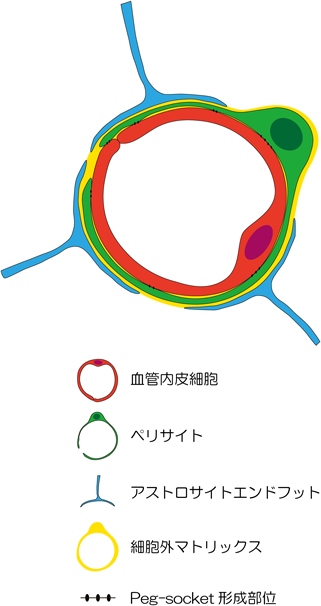
ペリサイトは,微小血管の血管内皮細胞周囲をfoot processで包み込んでいるが,IV型コラーゲンやラミニンリッチな血管の基底膜に埋没し共有していることが電子顕微鏡レベルの観察で示された(図1).また,ペリサイトと血管内皮細胞は完全に基底膜で隔てられているわけではなく,peg-socket(図1)を形成し,互いが直接コンタクトできる特異な構造を有する1).
脳血管には,血液脳関門(blood-brain barrier:BBB)と呼ばれる血流と神経組織間の物質移行を極度に制限したバリアが存在する.脳微小血管は,解剖学的には血管内皮細胞が形成する管腔構造の外周をペリサイトが被覆し基底膜を共有しており,それらの最外側をアストロサイトのfoot processが取り囲んでいる(図1).したがって,BBBの機能発現において,ペリサイトの存在を無視することはできない.このような解剖学的位置関係から,近年neurovascular unit理論が台頭してきており,neurovascular unitを形成する主要な細胞群である血管内皮細胞,ペリサイト,アストロサイトなどの協調的働きによってBBBの機能発現がなされると考えられるようになった.
ペリサイトは,微小血管周囲に存在することから微小血管のホメオスタシスを調節しているとされるが,生理学的にどのような役割を果たしているのか,根底にある分子シグナルは何なのかなど不明な点が多い.中枢神経系におけるペリサイトの機能として,Peppiattらが行った生理学的な研究によると,電気刺激やATPの局所投与によって,脳微小血管や網膜微小血管のペリサイトが収縮することが示され,ペリサイトが血流調整に重要な役割を果たすことが明らかとなった2).また,精力的なノックアウト(KO)マウスの作出と解析の結果から,ペリサイトの発生や機能に関わる分子群として,PDGF-BB(platelet-derived growth factor-BB)やPDGFRβ(platelet-derived growth factor receptor β)が同定された.PdgfbやPdgfrb遺伝子のnullマウス(KO)は胎生致死となるが,胎仔脳を詳細に調べてみるとペリサイトの大部分が消失しており,脳血管の異常走行や毛細血管瘤の形成が観察された3).さらにPDGF-BBのretention motifを欠失したマウス(Pdgfbret/ret)やPDGFRβのチロシンをフェニルアラニンに置換したマウス(PdgfrbF7/F7),さらに我々が作出した全身性PDGFRβコンディショナルノックアウト(CKO)マウスでは,ペリサイトの低形成または大部分の消失による脳血管のバリア機能破綻と血管透過性亢進が認められた.これらの結果から,ペリサイトの発生や血管機能維持にPDGF-BB-PDGFRβシグナルが重要な役割を果たしていることが証明された4–6).
中枢神経系以外の組織におけるペリサイトの役割は,それほど多くのエビデンスがないのが現状である.しかしその中でも,血液濾過で重要な役割を果たしている臓器である腎臓の機能発現に関して,ペリサイトの役割が重要であると考えられている.糸球体にはメサンギウム細胞(mesangial cell)の存在が知られているが,この細胞こそが糸球体特異的なペリサイトである.メサンギウム細胞はmesangial angleと称される部位で糸球体血管内皮細胞を捕捉しており,収縮性に富むアクチン繊維によって糸球体基底膜を牽引し,糸球体毛細血管の高い内圧に対して血管径を維持することに貢献し,濾過面積確保と濾過機能維持に重要な役割を果たしているとされる.事実,Pdgfbret/retマウスでは,メサンギウム細胞の発生障害によって,糸球体の形態異常(glomerulosclerosis)と機能異常(albuminuria)が報告されている.
微小血管において,ペリサイトの低形成や消失による血管系の拡張が認められることが多いが,そのメカニズムは完全に解明されていない.Arimaらのエレガントなex vivoの実験結果から,血管が伸長する際にペリサイトの働きを抗PDGFRβ抗体(APB5)でブロックすると血管拡張が認められた.対照群では,血管の伸長方向に対して正方向に多くの血管内皮細胞が移動していたが,APB5存在下では負の方向へ移動する血管内皮細胞が有意に増加するため,血管拡張が起こるという新しいメカニズムが提唱された7).
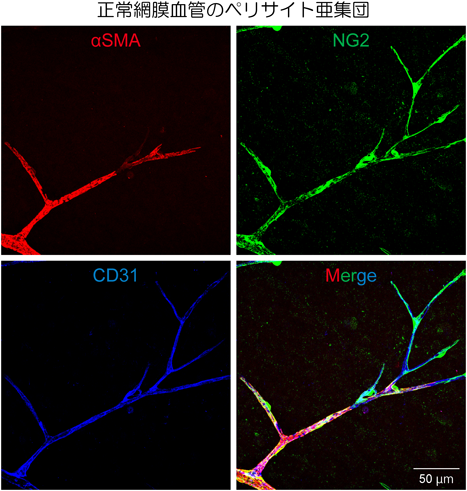
今日まで,分子生物学や細胞生物学などの生命科学研究領域では,特異分子マーカーの発見をきっかけにして多くの画期的な研究報告がなされてきた.ペリサイト研究分野に関しても,これまでにαSMA(α-smooth muscle actin),PDGFRβ, NG2(neuron-glial antigen 2)等の分子マーカーが報告されている(表1).多くの研究がこれら分子マーカーを使用し,免疫組織化学的検討やGFPなどを組み込んだレポータータンパク質発現によってペリサイトを可視化し追跡してきた.しかし,これらのマーカーは他の異なる細胞群(たとえば間葉系細胞や線維芽細胞,さらには神経細胞など)にも発現が確認されている分子マーカーであることも同時に知られており,それゆえペリサイトの絶対的な分子マーカーと断ずることはできない.そのようなことから,これまでのペリサイト研究では,上記分子マーカー陽性かつ微小血管を被覆している形態という最低限二つの指標をクリアする細胞をペリサイトであるとして扱ってきた.しかしながら,ペリサイト分子マーカーの発現は,たとえ同一組織内でも個々のペリサイトによって変化に富み一定ではない場合が多い(図2).また,定常状態や病的状態における同一組織を比較する場合においても,胎仔期から発生期さらには成体に至る過程における同じ組織においても,分子マーカーの発現は個々のペリサイトで一定しない場合がしばしば認められる.さらに同一ペリサイトにおける分子マーカーの経時的な変化も考慮する必要がある.これらの理由がペリサイト研究を困難なものにしている主要因である.今後,ペリサイトの絶対的な分子マーカーの発見が強く期待される.
表1 使用頻度の高いペリサイトマーカー| マーカー名 | シンボル | 機能 | 文献 |
|---|
| ATP-binding cassette subfamily C member 9 | Abcc9 | カリウムチャネル | Bondjers et al. (2006) FASEB J, 20, 1703–5. |
| ATP-sensitive inward rectifier potassium channel 8 | Kcnj8 | カリウムチャネル | Bondjers et al. (2006) FASEB J, 20, 1703–5. |
| Aminopeptidase N (CD13) | Anpep | 細胞膜アミノペプチダーゼ | Kunz et al. (1994) J Neurochem, 62, 2375–86. |
| αSMA (actin, aortic smooth muscle) | Acta2 | 細胞骨格タンパク質 | Nehls & Drenckhahn (1993) Histochemistry, 99, 1–12. |
| Cell surface glycoprotein MUC18 (CD146) | Mcam | 膜タンパク質 | Chen et al. (2017) Proc Natl Acad Sci USA, 114, E7622–E7631. |
| Desmin | Des | 中間系フィラメント | Nehls et al. (1992) Cell Tissue Res, 270, 469–74. |
| Endosialin | Cd248 | 膜タンパク質 | Christian et al. (2008) Am J Pathol, 172, 486–94. |
| NG2 (chondroitin sulfate proteoglycan 4) | Cspg4 | 細胞膜プロテオグリカン | Ozerdem et al. (2001) Dev Dyn, 222, 218–27. |
| Huang et al. (2010) Dev Biol, 344, 1035–46. |
| Ninjurin-1 | Ninj1 | 膜タンパク質 | Matsuki et al. (2015) Circ J, 79, 1363–71. |
| PDGFRβ (platelet-derived growth factor receptor beta; CD140b) | Pdgfrb | 受容体型チロシンキナーゼ | Lindahl et al. (1997) Science, 277, 242–5. |
| Protein delta homolog 1 | Dlk1 | 膜タンパク質 | Bondjers et al. (2006) FASEB J, 20, 1703–5. |
| RGS5 (regulator of G-protein signaling 5) | Rgs5 | Gタンパク質調節因子 | Bondjers et al. (2003) Am J Pathol, 162, 721–9. |
| Cho et al. (2003) FASEB J, 17, 440–2. |
ペリサイトの起源には諸説あり,統一された見解は得られていない.これまでに,有力な細胞ソースとして間葉系細胞,神経堤細胞が報告されている.近年,これらの細胞に関して蛍光リポータータンパク質発現とライブ画像を駆使した秀逸な研究がなされた.Andoらはペリサイトが構成的にmCherryで標識され,さらに神経堤由来細胞特異的Creまたは中胚葉由来細胞特異的Creによってペリサイトの標識がmVenusに切り替わるトランスジェニック(Tg)ゼブラフィッシュを作出し実験を行った.その結果,頭部のペリサイトは神経堤由来細胞が支配的であるのに対して,体幹部のペリサイトは中胚葉由来細胞が支配的であった8).これらの報告を統合して考えると,頭部,特に中枢神経系の血管は神経堤細胞由来ペリサイトによる被覆率が高く,体幹部は主に中胚葉由来ペリサイトが血管被覆に貢献しているものと考えられる.
またBirbrairらは,上記とは異なるリポーター発現系を用いて,骨格筋組織におけるペリサイトのタイピングを行った.Nestin-GFP−/NG2-DsRed+で識別されるペリサイトをtype-1とし,Nestin-GFP+/NG2-DsRed+をtype-2と分類した9).type-2ペリサイトはαSMAを発現するペリサイトであるばかりでなく,神経細胞マーカーであるneuron-specific class III β-tubulinを発現することから,細胞療法への期待が持てると考えられる.近年我々は,PDGFRα CKOマウス脳で一時的にオリゴデンドロサイト前駆細胞(OPC)が消失し,3週間後に再生することを発見した.OPCは脳室下帯に存在する神経幹細胞由来であると想像されたが,驚くべきことに,再生OPCは脳血管周囲または髄膜に存在するペリサイト由来であることが明らかとなった.これらペリサイトは,一時的にNestinを発現し,血管周囲から逸脱した後にOPCマーカーであるPDGFRαを発現し,OPC特異的な形態と脳内分布を示すことが明らかとなった10).これらの報告から,Nestinを発現するペリサイトはペリサイトの中でも組織幹細胞様のポテンシャルを有する亜集団であることが強く示唆される.
近年我々は,マウス胎仔の神経発生期を詳細に観察し,ペリサイトの新たな起源を探索することに挑戦した11).発達中のマウス胎仔脳血管のvascular frontには,CD31陽性かつF4/80陽性の貪食能を有する成熟したマクロファージが多数リクルートされ,その一部はペリサイト分子マーカーのNG2陽性であることを見いだした.マクロファージ系細胞の発生が障害されるCsf1op/opマウスの解析では,CD31+F4/80+細胞は脳血管にリクルートされず,その結果,発達中の脳血管におけるペリサイト被覆率は対照群と比較して有意に低いことが明らかとなった.さらに,胎仔期の造血器官である卵黄嚢からCD31+F4/80+NG2−細胞をソーティングし,血管内皮細胞や網膜と培養した結果,CD31+F4/80+NG2−細胞はNG2陽性のペリサイトに分化転換(transdifferentiation)していた.これより,成熟マクロファージ亜集団が脳微小血管ペリサイトの起源であることが明らかとなった11).皮膚血管においても,本研究を支持する報告がなされている.
さらに我々は,神経系および神経堤細胞特異的にCreを発現しmCherryでfate mappingできるマウスを使用して網膜の解析を行った.その結果,網膜血管周囲のペリサイトはmCherry陽性の亜集団とmCherry陰性の亜集団が存在することが明らかとなった.また,同CreでPDGFRβをCKOしたマウスの網膜では,NG2+αSMA−ペリサイト亜集団(mCherry陽性の亜集団と同義)は網膜からほぼ消失し,NG2+αSMA+ペリサイト亜集団(mCherry陰性の亜集団と同義)が残存していることを見いだした(次節「ペリサイトの関与が強く疑われる病態」参照).このことから,網膜血管を被覆するペリサイトには少なくとも2種類の亜集団が存在することが明らかとなった12).
1)糖尿病網膜症とペリサイト
ヒト糖尿病網膜症は,糖尿病の高血糖状態がもたらす重篤な網膜病態のことであり,糖尿病網膜症後期では病的血管新生と増殖膜形成による網膜剥離が原因で失明に至る.これまでは,高血糖を呈する動物モデルを作出することができても,重度の病的血管新生と増殖膜形成による網膜剥離は再現できなかった.
PDGF-BB-PDGFRβシグナルをターゲットとした研究から,ペリサイトの正常な発生を阻害することが,ヒト糖尿病網膜症の症状を再現しうることが報告された.Engeらの報告によると,PDGF-BBを血管内皮細胞特異的にCKOしたマウス(Pdgfblox/−)では,脳のペリサイト被覆率が野生型と比較して<50%の場合,病的血管新生や網膜の牽引などの網膜症症状が発現した13).
また,Oguraらは,抗PDGFRβ抗体(APB5)を生後1日目の仔マウスに投与し,大部分の網膜ペリサイトの発生を阻害し,再現性よく網膜症を誘導することができる秀逸なモデルを開発している.APB5を40 µg投与したケースでは,生後10日目ですべての個体で異常な血管新生とともに網膜の浮腫や出血が認められ,重症例では網膜の崩壊が観察された14).
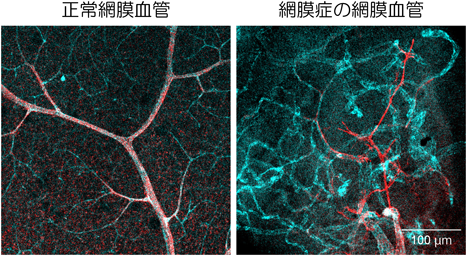
一方,我々は,神経系および神経堤細胞特異的にCreを発現しPDGFRβをCKOできるマウスを作出し,網膜の解析を行った.その結果,網膜微小血管に偏在するNG2+αSMA−ペリサイト亜集団が網膜からほぼ消失し,網膜細動静脈やそれらの分枝に遍在するNG2+αSMA+ペリサイト亜集団が残存していることを見いだした.NG2+αSMA−ペリサイト亜集団の消失がトリガーとなり極度の病的血管新生が観察されるとともに,NG2+αSMA+ペリサイト亜集団の異常な遊走,血管からの逸脱(pericyte-fibroblast transition:PFT),異常増殖による増殖膜形成が確認され,これが牽引性網膜剥離の原因となることを証明した(図3)12).
2)認知症とペリサイト
認知症は,アルツハイマー型認知症(AD),血管性認知症(VaD),レビー小体型認知症(BLD)などに大別されるが,ペリサイトが病態進行に関与している可能性が高いのがVaDである.VaDには孤発性のものが多い中,遺伝性血管性認知症であるcerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy(CADASIL)は,単一遺伝子疾患として知られ,責任遺伝子としてNOTCH3が同定されている15).
CADASILは,NOTCH3の機能を発揮するのに重要な部位である細胞外ドメインのEGFリピート部位に遺伝子変異が集中しており,これまで200種以上の変異が報告されているが,その95%以上がミスセンス変異である.これらの変異が原因で,ペリサイトのアポトーシスが起こると考えられている.事実,Notch3 KOマウスは,血管周囲のペリサイトや血管平滑筋細胞の被覆率が減少しており,アポトーシスが原因であることが示されている16).また,脳ペリサイトではNotch3がペリサイトとしての性質を表すことに重要な役割を果たしていることがゼブラフィッシュで証明された17).これらのエビデンスから,ペリサイトの機能不全が遺伝性血管性認知症の要因となることが強く示唆される.
3)腫瘍とペリサイト
腫瘍実質は,腫瘍細胞ばかりでなく,血管内皮細胞,ペリサイト,線維芽細胞,炎症性細胞およびさまざまな前駆細胞を含む多様な細胞群により構成されている.それら細胞群は,腫瘍細胞の増殖や生存にとって都合のよい腫瘍微小環境を形成していると考えられている.腫瘍血管におけるペリサイトの役割はいまだ議論の渦中にあるが,最近のトレンドでは,ペリサイトが腫瘍血管のnormalizationに重要であると考えられている.また,ペリサイトが腫瘍血管から逸脱し,cancer-associated fibroblast(CAF)に分化して腫瘍の微小環境形成や転移促進に関与している可能性も考えられる.
a.腫瘍血管のnormalization
Sox17iΔECマウスにLLC(Lewis lung carcinoma)を移植した実験では,対照群と比較して腫瘍血管におけるペリサイト被覆率が有意に高く,腫瘍血管からのEvans blueの漏出が有意に減少していたため,腫瘍血管のnormalizationが要因であると推察された18).また,シスプラチンの投与によって,Sox17iΔECマウスの腫瘍は対象群と比較して有意に小さかったことから,腫瘍血管のnormalizationが腫瘍実質深部への薬剤送達に有用であるものと推察される.同様の結果がCD4 KOやTCR KOマウスを用いた研究でも報告されている.
一方で,我々が行ったPDGF-BBを構成的に発現するgliomaの移植モデルでは,対象群はペリサイトが血管周囲を多層かつルーズに取り巻いていたが,PDGFRα CKOマウスの腫瘍血管ペリサイトは正常血管と同様に単層かつタイトな被覆様式であった.さらに血管機能をIgGの漏出で測定したところ,PDGFRα CKOマウスは有意にIgGの漏出が制限されており,出血傾向もみられなかった19).これらのエビデンスから,ペリサイトの正常な被覆形態が腫瘍血管のnormalizationに寄与すると考えられ,上述した分子が新規創薬ターゲットとなりうることが示唆される.
b.Cancer-associated fibroblast(CAF)
CAFの出自はまだ不明な点が多く,腫瘍近傍に存在する線維芽細胞や骨髄由来の間葉系細胞などであると予測されている.一方で,最近の知見から,ペリサイトが一つのソースであると考えられ始めている.
マウスPDGF-BB産生腫瘍移植モデルを詳細に解析したHosakaらの研究によると,腫瘍が産生する高濃度のPDGF-BBをペリサイトがPDGFRβで受容することで,血管内皮細胞上から腫瘍細胞方向に誘引され血管から逸脱する現象が観察された(pericyte-fibroblast transition, PFT).PFTによりペリサイトが血管から逸脱すると,血管内皮細胞どうしの結合がルーズな状態となる.このことが腫瘍の浸潤や転移に重要な役割を果たすと考えられ20),腫瘍血管のペリサイトが創薬ターゲットとなる可能性が考えられる.
フランスの生理学者Rougetがペリサイト(Rouget cell)を発見してから,150年が経過しようとしている.ペリサイト研究は長期にわたり進展しなかったが,漸く近年,分子マーカーの発見やKOマウスやTgゼブラフイッシュなどのモデル動物の開発によって,多くの研究者がペリサイトを対象とした研究を展開することができるようになった.これらのツールを用い,分子生物学的,発生学的,病態生理学的研究を粘り強く行ってきた結果,ペリサイトに関する数々の新しい知見が持たらされた.
しかしながら,ペリサイト研究領域は,いまだ絶対的分子マーカーがないことに加え,ペリサイトが複数の細胞ソースを起源とすることや,各組織における形態や局在さらには機能の違いなどから画一的な研究手法が適用できず,多くの困難を伴うが価値ある研究領域である.今後,基礎生物学的視点から,ペリサイトの絶対的分子マーカーの探索や,組織におけるheterogeneityの理由を明らかにすることが強く求められる.また,医学的視点からは,病態におけるペリサイトの役割の明確化や,ペリサイトを利用した組織再生理論の確立,さらにはペリサイトをターゲットとした医薬品の開発などの展開が強く期待される.
引用文献References
1) Armulik, A., Genove, G., & Betsholtz, C. (2011) Pericytes: developmental, physiological, and pathological perspectives, problems, and promises. Dev. Cell, 21, 193–215.
2) Peppiatt, C.M., Howarth, C., Mobbs, P., & Attwell, D. (2006) Bidirectional control of CNS capillary diameter by pericytes. Nature, 443, 700–704.
3) Hellstrom, M., Kalen, M., Lindahl, P., Abramsson, A., & Betsholtz, C. (1999) Role of PDGF-B and PDGFR-beta in recruitment of vascular smooth muscle cells and pericytes during embryonic blood vessel formation in the mouse. Development, 126, 3047–3055.
4) Armulik, A., Genové, G., Mäe, M., Nisancioglu, M.H., Wallgard, E., Niaudet, C., He, L., Norlin, J., Lindblom, P., Strittmatter, K., et al. (2010) Pericytes regulate the blood-brain barrier. Nature, 468, 557–561.
5) Daneman, R., Zhou, L., Kebede, A.A., & Barres, B.A. (2010) Pericytes are required for blood-brain barrier integrity during embryogenesis. Nature, 468, 562–566.
6) Shen, J., Ishii, Y., Xu, G., Dang, T.C., Hamashima, T., Matsushima, T., Yamamoto, S., Hattori, Y., Takatsuru, Y., Nabekura, J., et al. (2012) PDGFR-beta as a positive regulator of tissue repair in a mouse model of focal cerebral ischemia. J. Cereb. Blood Flow Metab., 32, 353–367.
7) Arima, S., Nishiyama, K., Ko, T., Arima, Y., Hakozaki, Y., Sugihara, K., Koseki, H., Uchijima, Y., Kurihara, Y., & Kurihara, H. (2011) Angiogenic morphogenesis driven by dynamic and heterogeneous collective endothelial cell movement. Development, 138, 4763–4776.
8) Ando, K., Fukuhara, S., Izumi, N., Nakajima, H., Fukui, H., Kelsh, R.N., & Mochizuki, N. (2016) Clarification of mural cell coverage of vascular endothelial cells by live imaging of zebrafish. Development, 143, 1328–1339.
9) Birbrair, A., Zhang, T., Wang, Z.M., Messi, M.L., Enikolopov, G.N., Mintz, A., & Delbono, O. (2013) Skeletal muscle pericyte subtypes differ in their differentiation potential. Stem Cell Res. (Amst.), 10, 67–84.
10) Đặng, T.C., Ishii, Y., Nguyen, V., Yamamoto, S., Hamashima, T., Okuno, N., Nguyen, Q.L., Sang, Y., Ohkawa, N., Saitoh, Y., et al. (2019) Powerful Homeostatic Control of Oligodendroglial Lineage by PDGFRalpha in Adult Brain. Cell Rep., 27, 1073–1089.e5.
11) Yamamoto, S., Muramatsu, M., Azuma, E., Ikutani, M., Nagai, Y., Sagara, H., Koo, B.N., Kita, S., O’Donnell, E., Osawa, T., et al. (2017) A subset of cerebrovascular pericytes originates from mature macrophages in the very early phase of vascular development in CNS. Sci. Rep., 7, 3855.
12) Kitahara, H., Kajikawa, S., Ishii, Y., Yamamoto, S., Hamashima, T., Azuma, E., Sato, H., Matsushima, T., Shibuya, M., Shimada, Y., et al. (2018) The Novel Pathogenesis of Retinopathy Mediated by Multiple RTK Signals is Uncovered in Newly Developed Mouse Model. EBioMedicine, 31, 190–201.
13) Enge, M., Bjarnegård, M., Gerhardt, H., Gustafsson, E., Kalén, M., Asker, N., Hammes, H.P., Shani, M., Fässler, R., & Betsholtz, C. (2002) Endothelium-specific platelet-derived growth factor-B ablation mimics diabetic retinopathy. EMBO J., 21, 4307–4316.
14) Ogura, S., Kurata, K., Hattori, Y., Takase, H., Ishiguro-Oonuma, T., Hwang, Y., Ahn, S., Park, I., Ikeda, W., Kusuhara, S., et al. (2017) Sustained inflammation after pericyte depletion induces irreversible blood-retina barrier breakdown. JCI Insight, 2, e90905.
15) Joutel, A., Corpechot, C., Ducros, A., Vahedi, K., Chabriat, H., Mouton, P., Alamowitch, S., Domenga, V., Cécillion, M., Marechal, E., et al. (1996) Notch3 mutations in CADASIL, a hereditary adult-onset condition causing stroke and dementia. Nature, 383, 707–710.
16) Liu, H., Zhang, W., Kennard, S., Caldwell, R.B., & Lilly, B. (2010) Notch3 is critical for proper angiogenesis and mural cell investment. Circ. Res., 107, 860–870.
17) Ando, K., Wang, W., Peng, D., Chiba, A., Lagendijk, A.K., Barske, L., Crump, J.G., Stainier, D.Y.R., Lendahl, U., Koltowska, K., et al. (2019) Peri-arterial specification of vascular mural cells from naive mesenchyme requires Notch signaling. Development, 146, dev165589.
18) Yang, H., Lee, S., Lee, S., Kim, K., Yang, Y., Kim, J.H., Adams, R.H., Wells, J.M., Morrison, S.J., Koh, G.Y., et al. (2013) Sox17 promotes tumor angiogenesis and destabilizes tumor vessels in mice. J. Clin. Invest., 123, 418–431.
19) Zheng, Y., Yamamoto, S., Ishii, Y., Sang, Y., Hamashima, T., Van De, N., Nishizono, H., Inoue, R., Mori, H., & Sasahara, M. (2016) Glioma-Derived Platelet-Derived Growth Factor-BB Recruits Oligodendrocyte Progenitor Cells via Platelet-Derived Growth Factor Receptor-alpha and Remodels Cancer Stroma. Am. J. Pathol., 186, 1081–1091.
20) Hosaka, K., Yang, Y., Seki, T., Fischer, C., Dubey, O., Fredlund, E., Hartman, J., Religa, P., Morikawa, H., Ishii, Y., et al. (2016) Pericyte-fibroblast transition promotes tumor growth and metastasis. Proc. Natl. Acad. Sci. USA, 113, E5618–E5627.