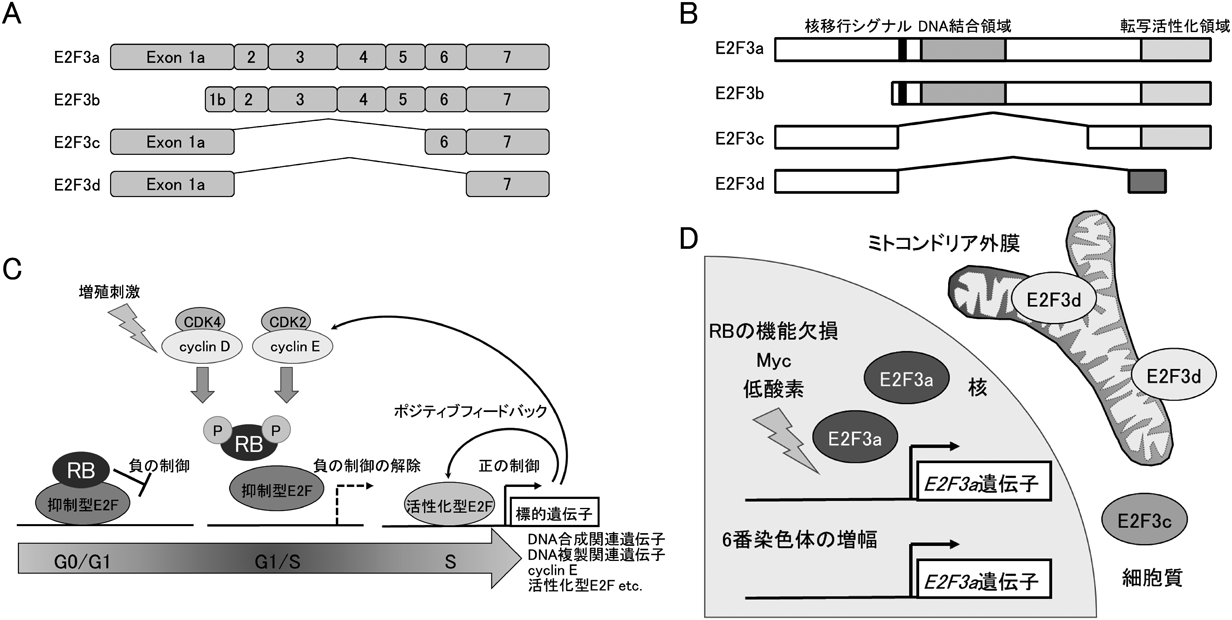
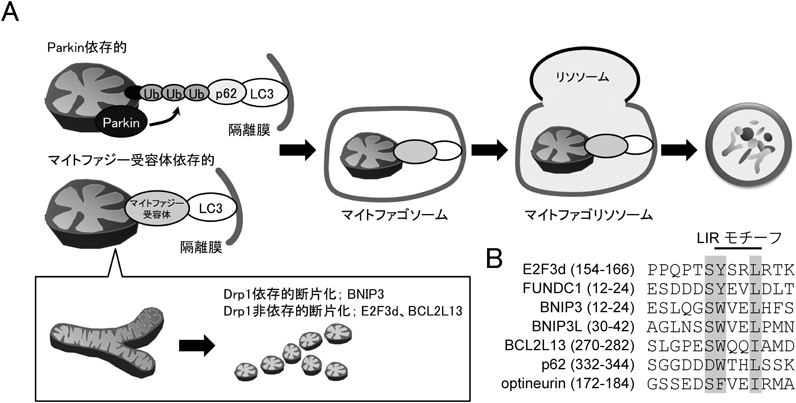
がん細胞におけるE2Fファミリーの新たな役割——新規メンバーE2F3dによるミトコンドリア品質管理機構——E2F3d, a novel E2F family member, contributes to mitochondrial quality control in cancer
関西学院大学理工学部生命医化学科Department of Biomedical Chemistry, School of Science and Technology, Kwansei Gakuin University ◇ 〒669–1337 兵庫県三田市学園2丁目1番地V号館三階 ◇ 2–1 Gakuen, Sanda, Hyogo 669–1337, Japan