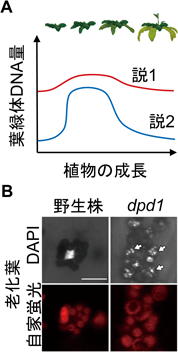
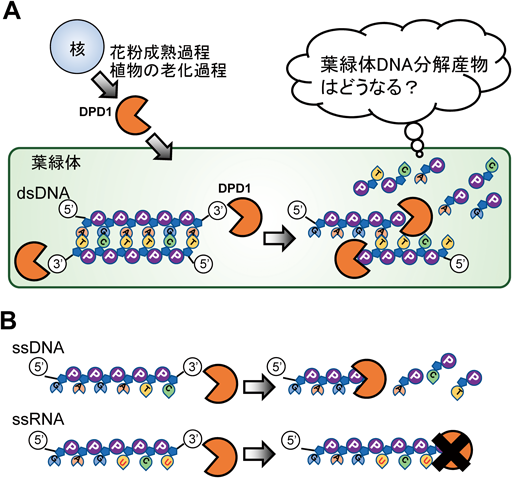
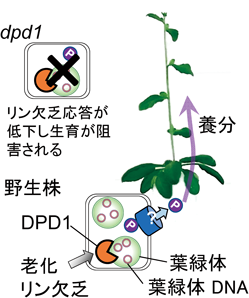
葉緑体DNA分解による種子植物のリン再利用戦略Degradation of chloroplast DNAs as an efficient strategy for phosphorus recycling in seed plants
岡山大学資源植物科学研究所Institute of Plant Science and Resources, Okayama University ◇ 〒710–0046 岡山県倉敷市中央2–20–1 ◇ 2–20–1 Chuo, Kurashiki, Okayama 710–0046, Japan