食品は,栄養(一次機能),嗜好(二次機能)および,生体調節(三次機能)という三つの生物学的な機能を持つ.たとえば,単純糖質(単糖類・二糖類)は,エネルギー源となる栄養素であり,糖質が有する甘味は嗜好を刺激する.また,糖質は脳の機能など各種の生理機能を調節する.このような重要な栄養素に対する体のニーズを脳に伝え,その摂取を制御する「食欲の調節システム」が存在することにより,生体の恒常性が維持されている.
近年の恒常的摂食調節の研究の多くは,栄養素ではなく「エネルギー」に着目して進められてきた.遺伝学的な解析の発展に伴い,身体のエネルギー貯蔵量を反映するレプチンと,空腹・満腹(エネルギーの欠乏・充足)を制御する中枢性メラノコルチン系を軸に,エネルギー収支を制御する臓器連関と脳内回路の解明が進んだ.しかし,「エネルギー」とひとくくりにすると,エネルギー産生物質と定義される三大栄養素(糖質,タンパク質,脂質)は区別できない.
糖質の摂取を特異的に調節するには,糖質を他の栄養素(タンパク質,脂質)と判別して制御する機能が必要だ.これまでに,脳内のグルコース感知神経細胞による摂食調節や,甘味に基づく摂食調節などが研究されてきた.このたび我々は,臓器連関シグナルfibroblast growth factor 21(FGF21)-オキシトシン(Oxytocin:OXT)系が,単純糖質への食欲(嗜好性)のネガティブ・フィードバック制御を担うことを解明した1).本稿では,この新たな臓器連関シグナルと,味覚と内分泌反応の条件づけ学習(頭相反応)の重要性について概説する.
1)FGF21
FGF21は,FGFスーパーファミリーに属する内分泌性のFGFの一つである.FGF21は各種の刺激に応じて分泌される多機能性のホルモンであり,複数の臓器で産生される.FGF21の血中濃度は,肝臓からのFGF21分泌によって規定され,絶食,単純糖質やアルコールの摂取など,各種の代謝性刺激により上昇する2).分泌されたFGF21は,標的細胞の表面に発現するFGF21受容体[FGF receptor(FGFR)とβ-Klothoのヘテロ二量体で構成される]に結合し,AKTおよびERKのシグナル経路を活性化する.FGFRの各種サブタイプは全身に広く発現しているのに対して,Klb遺伝子にコードされるβ-Klothoの発現分布は限局しているため,FGF21受容体の発現分布はβ-Klothoによって規定される.FGF21の標的組織には,脳,膵臓,脂肪組織などがあり,日内リズムの調節や,脂肪酸燃焼の促進などを担う.
FGF21は単純糖質への嗜好性を抑制することが,2016年に二つのグループから報告された3, 4).摂取された単純糖質は,肝臓でCarbohydrate response element binding protein(ChREBP)を活性化してFgf21の転写を誘導し,FGF21分泌を促進する.血中に分泌されたFGF21は,脳の視床下部室傍核に作用し単純糖質への嗜好性を抑制するが,舌での甘味受容(味覚)には影響を与えない.しかし,FGF21が活性化する視床下部室傍核の領域は,多様な神経細胞群を含む領域であり,FGF21による単純糖質嗜好性の抑制効果を担う標的神経細胞は未解明であった.
2)オキシトシン
オキシトシン(OXT)は9アミノ酸からなる環状ペプチドで,Gq型のGタンパク質共役型受容体であるオキシトシン受容体(OXTR)に作用する5).OXT陽性神経細胞は,主に脳内2か所(視床下部室傍核と視床下部視索上核)に存在し,下垂体後葉や脳内各所(海馬,前頭前皮質,側坐核,腹側被蓋野,など)に軸索を投射する.下垂体後葉から分泌されたOXTはホルモンとして全身作用を呈するのに対し,活動電位依存性に神経終末から脳内に分泌されるOXTは,神経伝達物質として作用する.さらに,OXT神経は通常の神経細胞と異なる性質を持ち,活動電位非依存性に樹状突起や細胞体からもOXTを分泌する.
ホルモンとしてのOXTは,分娩時の子宮収縮や乳汁の分泌を促進する.他方,神経伝達物質としてのOXTは,社交性の促進やストレス耐性の強化を担うとともに,摂食(特に炭水化物の摂取)を抑制する.単純糖質の摂取はOXT神経の活性化をもたらし,OXTの投与は単純糖質の摂取を抑制する.
3)FGF21-OXT系の発見
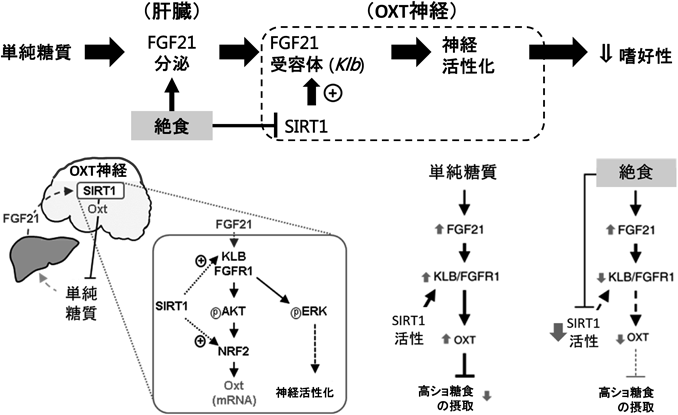
我々は,nicotinamide adenine dinucleotide(NAD+)依存性タンパク質脱アセチル化酵素Sirtuin 1(SIRT1)による食欲調節の研究を進める中で,中枢神経系のSIRT1がショ糖嗜好性を抑制することを発見した.その分子・神経基盤の解明が,単純糖質摂取に伴うネガティブ・フィードバック制御を担うFGF21-OXT系の発見につながった.そして,SIRT1はOXT神経のFGF21感受性を促進することで,単純糖質嗜好性を抑制することを解明した(図1).
OXT神経がFGF21の標的となるには,FGF21受容体の発現が必要である.そこでOXT神経の一部がFGF21受容体を発現することを組織学的に確認した.次に,視床下部室傍核のOXT神経細胞の約1/8がFGF21により活性化されることを,マウスへのFGF21の腹腔内投与実験と,視床下部室傍核から単離したOXT神経細胞へのFGF21添加実験の二つの方法により確認した.FGF21受容体の下流では,AKT経路とERK経路が活性化される.ERKの活性化は神経細胞の活性化マーカーでもあり,FGF21がERKを介してOXT神経を活性化することを示唆する.他方,活動電位非依存性に起こる「細胞体および樹状突起からのOXT分泌」はFGF21により誘導されなかった.FGF21によるAKT経路の活性化は,下流の標的転写因子nuclear factor erythroid 2 like 2(NRF2)を介してOxt遺伝子の転写を促進することを解明した.
OXT神経特異的にSIRT1の発現量を増加・欠損させると,Oxt遺伝子発現も増加・減少し,単純糖質嗜好性は減少・増加した.SIRT1→OXTによる単純糖質嗜好性の抑制は,OXTR阻害薬により消失するため,OXTのOXTRへの作用がSIRT1による単純糖質嗜好性の制御に必要である.SIRT1は,β-KlothoをコードするKlb遺伝子の発現を促進し,FGF21感受性を促進していた.
以上より,単純糖質摂取に伴い血中FGF21濃度が上昇し,FGF21がOXT神経に作用すると,Oxt遺伝子発現とOXT神経の活性化が起こり,神経投射先でOXTがOXTRを活性化して単純糖質への欲求が抑えられ,単純糖質嗜好性が抑制される.OXT陽性神経細胞のSIRT1は,FGF21感受性を促進して,単純糖質の摂取時に起こるFGF21-OXT系による糖摂取欲求のネガティブ・フィードバックを強める.
4)SIRT1によるFGF21-OXT系の調節の生理的意義
単純糖質の摂取時には,FGF21-OXT系が活性化して糖への欲求が抑えられることがわかったが,FGF21は絶食時にも血中濃度が上昇する2).しかし,絶食時には糖質嗜好性が亢進し,neuropeptide Y(NPY)とcorticotropin-releasing hormone(CRH)神経細胞のadenosine monophosphate-activated protein kinase(AMPK)がこの現象を担う6).つまり,絶食時に血中FGF21が高まった結果,OXT神経が活性化すると,実際に起こる糖質嗜好性の亢進という現象と拮抗することになる.この一見矛盾する現象は,SIRT1に着目することで解消された.
絶食時には,SIRT1とNAD+(酵素と補酵素)の両方が視床下部において減少し,視床下部でのSIRT1活性が低下することを我々は明らかにした.また絶食時には,KlbおよびOxtの遺伝子発現が低下しており,FGF21刺激に応じたOxt遺伝子の発現誘導は起こらなかった.つまり,通常の栄養状態(SIRT1活性があるとき)には,FGF21-OXT系による単純糖質摂取の抑制が起こる.しかし,エネルギーが欠乏する絶食時には,視床下部では(他の脳内部位と異なり)SIRT1活性が低下することで,エネルギー欠乏をすばやく解消できる糖の補給促進にブレーキをかけるFGF21-OXT系をoffにしていると解釈できる.
1)頭相反応(CPR)とは
食行動は,摂取前の予測にもとづくフィードフォワード制御と,摂取後の反応への応答にもとづくフィードバック制御により調節されている7).FGF21-OXT系は,糖摂取に伴うネガティブ・フィードバック制御機構を担う.他方,糖や人工甘味料などの甘味刺激は,糖の摂取後効果が起こるタイミングよりも前に,神経系を介して内分泌反応を引き起こすことが古くより知られている.この現象は頭相反応(cephalic phase response:CPR)と呼ばれ,糖摂取に伴う味覚刺激と糖の摂取後効果の間に成立した条件づけ関連学習である8).CPRは,甘味刺激の感知に応じて,予期される血糖値の上昇に対する予測的な内分泌代謝反応(例:インスリン分泌)であり,血糖値の上昇を緩徐にする生理的役割を担う9).食事による視覚刺激に応じて起こる肝臓での小胞体ストレス反応も,CPRの一種として報告されている10).
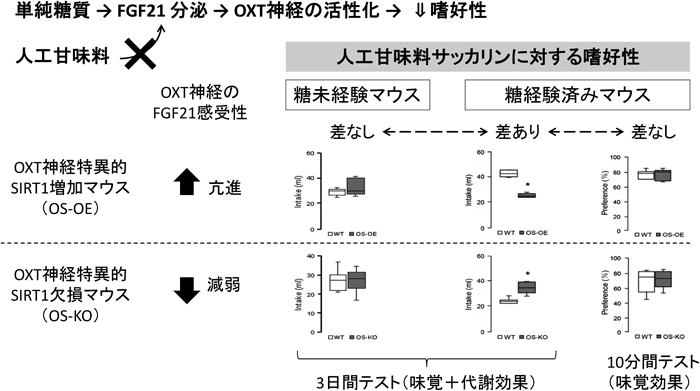
2)CPRによるFGF21分泌制御仮説
OXT神経特異的SIRT1増加・欠損(OS-OE・KO)マウスでは,糖応答性のFGF21分泌には変化がないが,OXT神経のFGF21感受性が亢進・減弱している.FGF21分泌は,単純糖質の代謝効果により誘導され,人工甘味料では誘導されない.OS-OE・KOマウスの人工甘味料への嗜好性は,糖溶液への曝露経験があると変容し,未経験だと差がなかった.糖溶液への曝露経験が,甘味刺激と代謝効果の間の条件づけ関連学習を促し,人工甘味料刺激でもCPRによるFGF21分泌を引き起こし,OXT神経でFGF21感受性が変容しているOS-OE・KOマウスの人工甘味料嗜好性を変化させたと推察される(図2).
3)人工甘味料とCPR
人工甘味料は,CPRの存在を証明する実験的手段の一つとして用いられてきた.人工甘味料(条件刺激のみ)により,条件反応(摂取後の代謝効果)を引き起こすからである.しかし,条件刺激のみを提示し続けると,条件づけ関連学習が消去され,条件反応は起こらなくなる11).つまり,人工甘味料の長期使用は,本来血糖調節に対して一定の役割を果たしている糖へのCPRを消去し,血糖調節能を悪化させる可能性があることが推察される(図3).
引用文献References
1) Matsui, S., Sasaki, T., Kohno, D., Yaku, K., Inutsuka, A., Yokota-Hashimoto, H., Kikuchi, O., Suga, T., Kobayashi, M., Yamanaka, A., et al. (2018) Neuronal SIRT1 regulates macronutrient-based diet selection through FGF21 and oxytocin signalling in mice. Nat. Commun., 9, 4604.
2) Fisher, F.M. & Maratos-Flier, E. (2016) Understanding the Physiology of FGF21. Annu. Rev. Physiol., 78, 223–241.
3) Talukdar, S., Owen, B.M., Song, P., Hernandez, G., Zhang, Y., Zhou, Y., Scott, W.T., Paratala, B., Turner, T., Smith, A., et al. (2016) FGF21 Regulates Sweet and Alcohol Preference. Cell Metab., 23, 344–349.
4) von Holstein-Rathlou, S., BonDurant, L.D., Peltekian, L., Naber, M.C., Yin, T.C., Claflin, K.E., Urizar, A.I., Madsen, A.N., Ratner, C., Holst, B., et al. (2016) FGF21 Mediates Endocrine Control of Simple Sugar Intake and Sweet Taste Preference by the Liver. Cell Metab., 23, 335–343.
5) Leng, G. & Sabatier, N. (2017) Oxytocin-The Sweet Hormone? Trends Endocrinol. Metab., 28, 365–376.
6) Okamoto, S., Sato, T., Tateyama, M., Kageyama, H., Maejima, Y., Nakata, M., Hirako, S., Matsuo, T., Kyaw, S., Shiuchi, T., et al. (2018) Activation of AMPK-Regulated CRH Neurons in the PVH is Sufficient and Necessary to Induce Dietary Preference for Carbohydrate over Fat. Cell Rep., 22, 706–721.
7) 佐々木努(2018)摂食調節研究のパラダイム・シフト——摂食調節に流れる三つの時間.実験医学,36, 64–65.
8) Berthoud, H.R., Bereiter, D.A., Trimble, E.R., Siegel, E.G., & Jeanrenaud, B. (1981) Cephalic phase, reflex insulin secretion neuroanatomical and physiological characterization. Diabetologia, 20(Suppl 1), 393–401.
9) Teff, K.L. & Engelman, K. (1996) Oral sensory stimulation improves glucose tolerance in humans: effects on insulin, C-peptide, and glucagon. Am. J. Physiol., 270, R1371–R1379.
10) Brandt, C., Nolte, H., Henschke, S., Engström Ruud, L., Awazawa, M., Morgan, D.A., Gabel, P., Sprenger, H.G., Hess, M.E., Günther, S., et al. (2018) Food Perception Primes Hepatic ER Homeostasis via Melanocortin-Dependent Control of mTOR Activation. Cell, 175, 1321–1335.e20.
11) Quirk, G.J. & Mueller, D. (2008) Neural mechanisms of extinction learning and retrieval. Neuropsychopharmacology, 33, 56–72.
12) Sasaki, T. (2017) Neural and Molecular Mechanisms Involved in Controlling the Quality of Feeding Behavior: Diet Selection and Feeding Patterns. Nutrients, 9, E1151.
13) Chu, A.Y., Workalemahu, T., Paynter, N.P., Rose, L.M., Giulianini, F., Tanaka, T., Ngwa, J.S., Qi, Q., Curhan, G.C., Rimm, E.B., et al.; CHARGE Nutrition Working Group; DietGen Consortium. (2013) Novel locus including FGF21 is associated with dietary macronutrient intake. Hum. Mol. Genet., 22, 1895–1902.
14) Tanaka, T., Ngwa, J.S., van Rooij, F.J., Zillikens, M.C., Wojczynski, M.K., Frazier-Wood, A.C., Houston, D.K., Kanoni, S., Lemaitre, R.N., Luan, J., et al. (2013) Genome-wide meta-analysis of observational studies shows common genetic variants associated with macronutrient intake. Am. J. Clin. Nutr., 97, 1395–1402.
15) Elbers, C.C., de Kovel, C.G., van der Schouw, Y.T., Meijboom, J.R., Bauer, F., Grobbee, D.E., Trynka, G., van Vliet-Ostaptchouk, J.V., Wijmenga, C., & Onland-Moret, N.C. (2009) Variants in neuropeptide Y receptor 1 and 5 are associated with nutrient-specific food intake and are under recent selection in Europeans. PLoS One, 4, e7070.