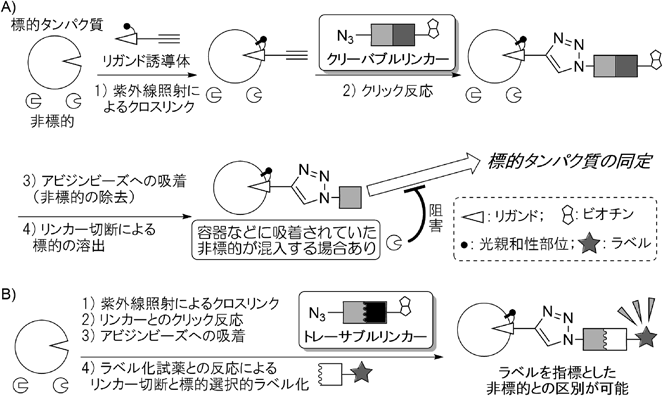
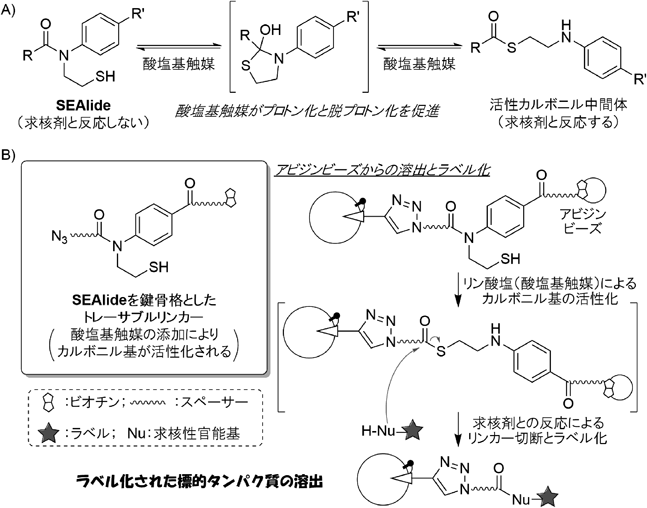
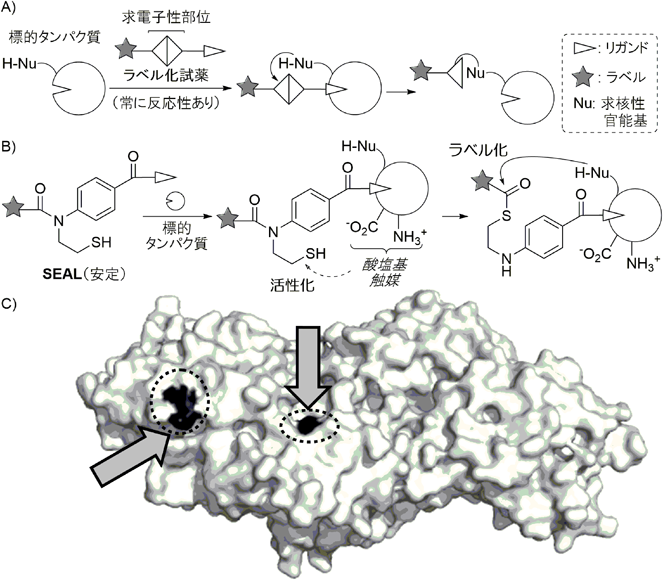
有機化学的視点からの標的タンパク質精製・機能解明ツールの開発Development of chemical tools for purification and functional elucidation of a protein of interest
徳島大学大学院医歯薬学研究部薬学域Institute of Health Biosciences and Graduate School of Pharmaceutical Sciences, Tokushima University ◇ 〒770–8505 徳島県徳島市庄町1–78–1 ◇ 1–78–1 Shomachi, Tokushima 770–8505, Japan