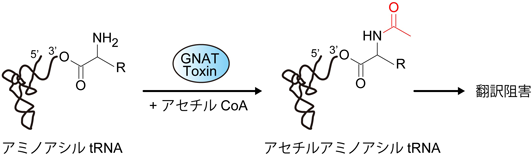
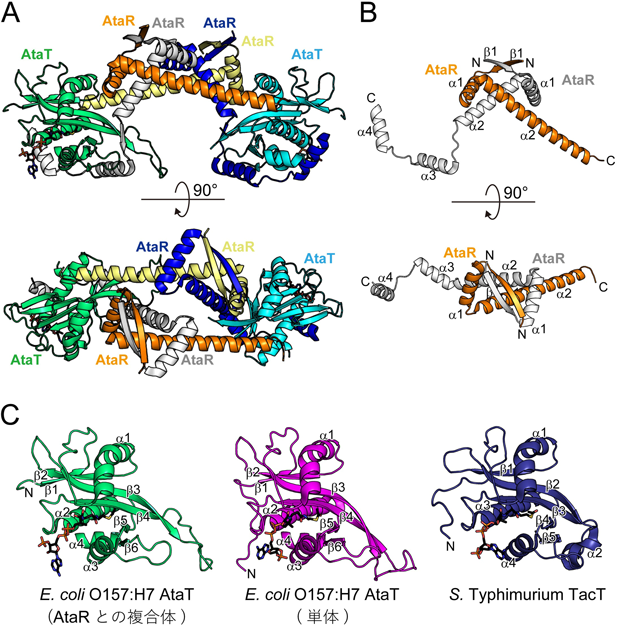
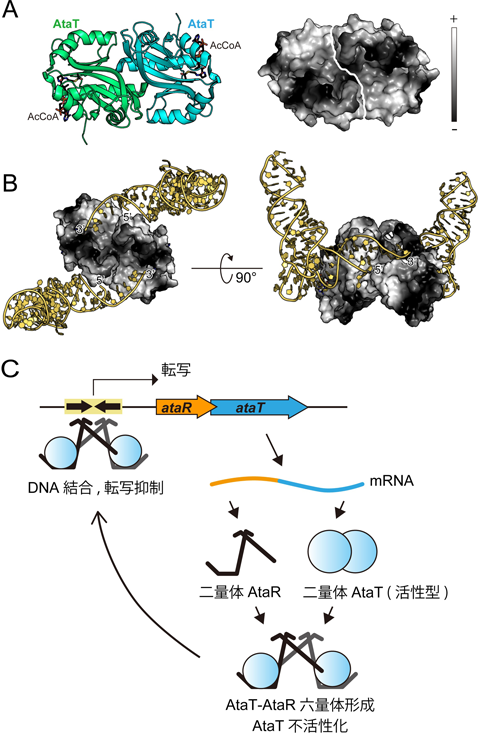
アミノアシル転移RNAを標的とするトキシンの活性制御メカニズムRegulatory mechanism of the toxin targeting aminoacyl tRNA
東京大学大学院新領域創成科学研究科メディカル情報生命専攻RNA生物学分野Department of Computational Biology and Medical Sciences, Graduate School of Frontier Sciences, The University of Tokyo ◇ 〒227–8562 千葉県柏市柏の葉5–1–5 生命棟702 ◇ Bldg. FSB-702, 5–1–5 Kashiwanoha, Kashiwa, Chiba Prefecture 277–8562, Japan