生細胞・生体組織を計測・診断する上で,非染色(無染色)・非標識(無標識)・非破壊・非侵襲(または低侵襲)な手法は理想的な手段の一つであろう.ラマン散乱,特にコヒーレント・ラマン散乱(非線形ラマン散乱の一種)を用いたイメージング法は,そのような特徴に加えて分子(正確には化学結合)識別能を持ち合わせた高速イメージング法であり,ラベルフリー・分子イメージングの新手法として,近年ますます注目を集めている1–9).
非線形ラマン・イメージング法では,コヒーレント・アンチストークス・ラマン散乱(coherent anti-Stokes Raman scattering:CARS)および誘導ラマン散乱(stimulated Raman scattering:SRS)の二つが,主な手法としてよく用いられている.さらに,これらの手法をベースとして,非線形ラマン分光(または非線形ラマン分光学的)イメージング(nonlinear Raman spectral/spectroscopic imaging)手法もいくつか報告されている.たとえば広帯域のスペクトル成分を持つ“白色”レーザー光源[正確にはスーパーコンティニューム光(supercontinuum:SC)]を用いて複数の振動モードを同時に励振させるマルチプレックス法10–16),レーザーの波長を高速に変化させてスペクトルおよび空間情報を得る方法17–21),チャープしたフェムト秒レーザーを用いる方法22),フーリエ変換を用いた干渉分光法23–26)等がこれまで報告されている.これらに加えて,2台の光コムを用いたデュアルコム分光によりCARS分光イメージングを行う研究(spectro-imaging)も報告されている27).これらのうちでマルチプレックス法10–14)は,CCDカメラ等のマルチチャンネル検出器を用いて幅広いスペクトル帯域を持つ信号光を一括して簡便に測定することのできる手法であり,典型的なスペクトル帯域は~3000 cm−1と,振動モードの基音(fundamental)すべてをカバーしており,既報の中で最もスペクトル帯域が広い16, 28).マルチプレックス法では,1台のモード同期レーザー発振器29, 30)を用いた方法や,白色レーザー光(SC光)を用いた手法12, 13)などがこれまで報告されている.後者では,SC光発生のために,マスターレーザーからの出力をテーパー状ファイバー12)やフォトニック結晶ファイバー(photonic crystal fiber:PCF)13)に導入する方法が一般的である.我々のグループではこれまで,白色レーザー光発生にサブナノ秒光パルス31)や~100ピコ秒パルス32)を用いることで,コストダウンと長期安定性を両立させたCARS分光学的イメージング装置を開発している.
非線形ラマン散乱に用いるレーザー光源は一般にパルスレーザーであるため尖頭出力が高く,CARSに加えて第二高調波発生(second harmonic generation:SHG),第三高調波発生(third harmonic generation:THG),二光子励起蛍光(two-photon excitation fluorescence)等の信号も同時に発生する.したがって,CARSをはじめとする複数の検出チャンネルを持った,いわゆるマルチモーダル非線形光学イメージングを行うことができる.我々はこれまで,ラベルフリー・マルチモーダル非線形光学イメージングにより,ルートレティン(Rootletin)33)というタンパク質により構成されたフィラメント(線毛根;rootlet)が,網膜視細胞においてSHGアクティブであることを報告している34).また,マウス頭頂骨のマルチモーダル非線形光学イメージングにより,pixel dwell time 5 msにて生体組織のex vivoマルチモーダル非線形光学イメージング(後方散乱配置)が可能であることも報告している35).
本稿では,CARSの原理と,我々が現在開発を進めているCARS分光学的イメージング装置の実際,そしてその生細胞への応用について解説する.
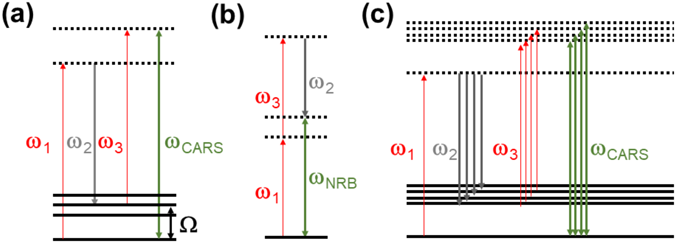
図1aにCARS過程のダイアグラムを示す.CARS過程では一般に二色のレーザー光(ω1,ω2光,またはポンプ光,ストークス光)を用いる.これら二つの入射光の角振動数差ω1−ω2が試料分子の持つ振動モードの角振動数Ωと一致すると(共鳴条件:ω1−ω2=Ω),レーザー照射された多数の試料分子の振動モードが共鳴励振される.このようにして生じた振動コヒーレンスは,試料分子が三つ目のレーザー光(ω3光,またはプローブ光)と相互作用することにより,角振動数ω3±Ωの三次の非線形分極に変換され,その分極からの光電場発生により,ωCARS[=ω3+Ω光(CARS光)]として取り出される[ωSRS(=ω3−Ω光)も同時に発生する;ω3=ω1の場合,誘導ラマン利得(stimulated Raman gain:SRG)に相当する].エネルギー保存則から,ωCARS=ω1−ω2+ω3であることが要請される.また,位相整合条件からCARS光はkCARS=k1−k2+k3の方向に発生する.ここで,kxはωx光の波数ベクトルである.ω3光として,通常はすでに入力済みのω1光が使われる.その場合(ω3=ω1),ωCARS光の信号強度はω1光およびω2光の強度の二乗および一乗にそれぞれ比例する.すなわち,CARS光の信号強度はω1光の強度に対して非線形に増大する.また,位相整合条件から,入射レーザーの進行方向に指向性のよいCARS光(前方散乱)を得ることができる.このように,信号光をコヒーレントかつ非線形に増幅することができるため,高速イメージングも可能になる.信号の増倍ファクターについては,顕微イメージングでは100倍36),バルク試料では~105倍37)程度強くなった,という報告がある.これらは,発生した信号光がどの程度の距離までコヒーレントに足し合わせられるか(コヒーレンス長)とも関係している.
通常のCARS顕微鏡では,ω1, ω2光として各々単色のレーザー光を用いるため,特定かつ単一の振動モードしか励振することができない.このことは,脂質分子のCH2伸縮振動(~2850 cm−1)のように,他のバンドから比較的離れ,鋭くかつラマン散乱断面積の大きい振動モードについては大きな問題とならないが,指紋領域のように多数のバンドが密集しているスペクトル領域では,以下述べるように注意が必要である.一般に,測定により得られる信号光(ω1−ω2+ω3)の成分には,振動モードに共鳴するCARS光の他に,図1bに示す非共鳴バックグラウンド(nonresonant background:NRB)と呼ばれる成分も含まれる(NRBの角振動数ωNRBもωNRB=ω1+ω3−ω2等で表され,ωCARSと同じ値になる).我々の経験では,特に生細胞の指紋領域のバンドを測定する際,振動共鳴CARS光はNRBと同じかそれ以下の強度となるため,単一波長のCARS測定では両者を分離することが難しい.複数の振動モードについての情報を同時に取得し,かつ,NRBのコンタミネーションのない,純粋に振動共鳴したCARS信号のみを得るために,我々は図1cに示したマルチプレックスCARS過程を用いてCARSスペクトルを取得している.この過程では広帯域ストークス光(ω2光)が必要になるが,高い空間コヒーレンスを持ちスポット状に集光することのできる白色レーザー光(SC光)により,それを実現している.
CARSスペクトルI(ω)は一般に以下の式で表される.ここで,ωは信号光の角振動数,χNRBはNRB(ωによらない複素数の定数;完全非共鳴の場合は実数),Anは振動共鳴CARS光の振幅,Ωnは振動共鳴角振動数,Γnは振動バンド幅に比例する係数である.第1項のNRBと第2項の振動共鳴信号とは電場どうしがコヒーレントで干渉するため,NRBが実数の場合,実測スペクトルは各々の振動共鳴位置において複素ローレンツ関数の実部(分散型)の形状になる.これを通常の振動スペクトルに復元するため,我々は最大エントロピー法(maximum entropy method:MEM)を用いている28).MEMの特徴として,スペクトル形状を式(1)のようなローレンツ型と仮定せず,実験で得られたスペクトルからダイレクトに正しいスペクトル(自発ラマンで得られるスペクトルに相当するIm[χ(3)]スペクトル)を復元できる,という利点があげられる38).そのおかげで,生体組織や生細胞においてよくみられる幅広い非対称な振動スペクトル形状も正しく復元することができる.
1)実験装置
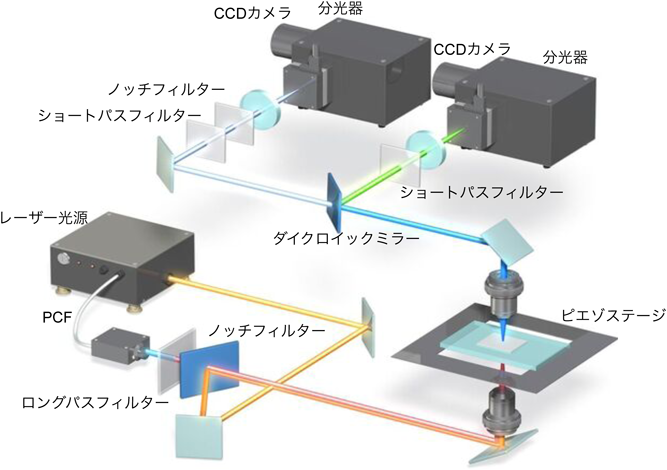
図2に典型的な実験装置図を示す.光源には,マスター発振器およびファイバー増幅器(master oscillator fiber amplifier:MOFA)(Leukos:SM-1000)を用いた.光源の詳細は以下のとおりである.マスター発振器にはcw Q-スイッチ・マイクロチップNd:YVO4レーザーを,ファイバー増幅器はYb添加ダブルクラッドファイバーを採用している.最終的な光源仕様は,中心波長,パルス幅,繰り返し周波数,平均出力がそれぞれ1064 nm, ~85 ps, ~0.82 MHz, ~2 Wであった.光源からの出力の一部をPCFに導入することで広帯域SC光を発生させ,ストークス光(ω2光)とした.SC光は可視から近赤外まで広帯域なスペクトル成分を持つが,そのうち1064 nm以上の波長成分のみを用いるため,吸収型および干渉型のフィルターを組み合わせて1100 nm以上の波長成分のみを切り出した.一方,残りの基本波(1064 nm)はそのままポンプ光(ω1光)として用いた.ポンプ光,ストークス光のパルスエネルギーはそれぞれ約2および1 µJであり,これは約24および12 kWの尖頭出力に対応する.
ポンプ光(ω1光)およびストークス光(ω2光)を,ノッチフィルターを用いて合波し,倒立顕微鏡と正立顕微鏡を合体させたカスタムメイドの正倒立顕微鏡へと導入した.二つのレーザーパルスは倒立側の水浸対物レンズ(CFI Plan Apo 60× NA 1.27, Nikon)を用いてサンプルへと集光した.サンプルは3軸ピエゾステージ上にマウントされており,面内・面外(光軸)方向の3次元スキャンが可能である.種々の非線形光学過程により発生したCARSを含む信号光は,正立側の対物レンズ(Plan S Fluor 40× NA 0.6, Nikon)を用いてコリメートされ,ダイクロイックミラーでCARSとSHG, THGを分割した後,それぞれ別の分光器に導入し,CCDカメラで検出した.今回,新規に導入したCCDカメラ(Blaze 400-HR, Princeton Instruments)をCARS光検出用に用いることで,測定速度の格段の向上に成功した.そこで本稿では,CARSの高速測定にフォーカスした研究結果を紹介する.
2)試料
生細胞サンプルとしてA549株を用いた.A549はヒト肺胞基底上皮腺がん細胞株である.この細胞の特徴として,細胞のリン脂質膜の維持に必要な不飽和脂肪酸を多く含んでいることがあげられる39).チェンバースライドにタイプIコラーゲンをコートした上で細胞をまき,ウシ血清(fetal bovine serum:FBS)10%入りのDulbecco’s Modified Eagle’s Medium中で37°C, CO2濃度5%のインキュベーター環境で2日間培養した.測定直前にインキュベーターから取り出し,チャンバーを取り除いてカバーガラスを置き,マニキュアで封じた上で即座に測定した.サンプル位置での入射レーザー出力は,ポンプ光,ストークス光でそれぞれ~80 mW, ~50 mWであった.
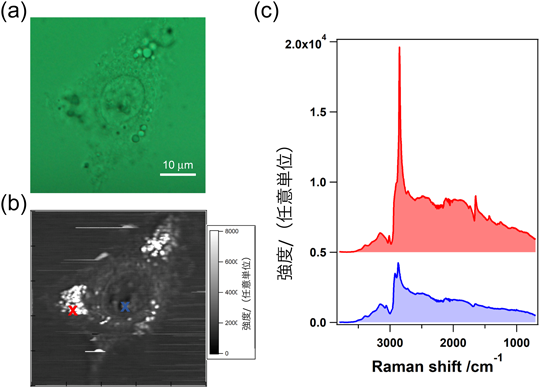
本装置を用いて生細胞(A549)を測定した結果について述べる.図3aおよびbに生細胞(A549)の光学像およびCARSイメージの結果を示す.図3bのCARSイメージは,測定スペクトルの2850 cm−1の波数位置に現れる見かけ上のピーク(図3cの上段のスペクトルにおいて特に顕著にみられている)信号強度値を用いて再構成した.1ピクセルあたりの露光時間は約10 msである.図3c上段および下段に示されたCARSスペクトル(実測スペクトル)は,図3bで細胞内にみられる明るい輝点の位置(中央左のX印)および中央付近の核内構造(中央のX印)でのものである.この波数2850 cm−1のバンドはCH2伸縮振動モードに帰属でき,細胞内脂質において強い信号が観測される.したがって,細胞内の明るい輝点は細胞内脂肪滴であると考えられる.
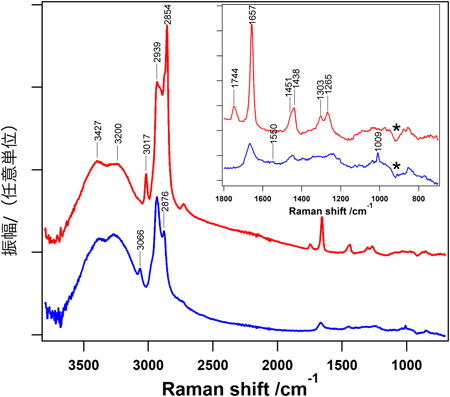
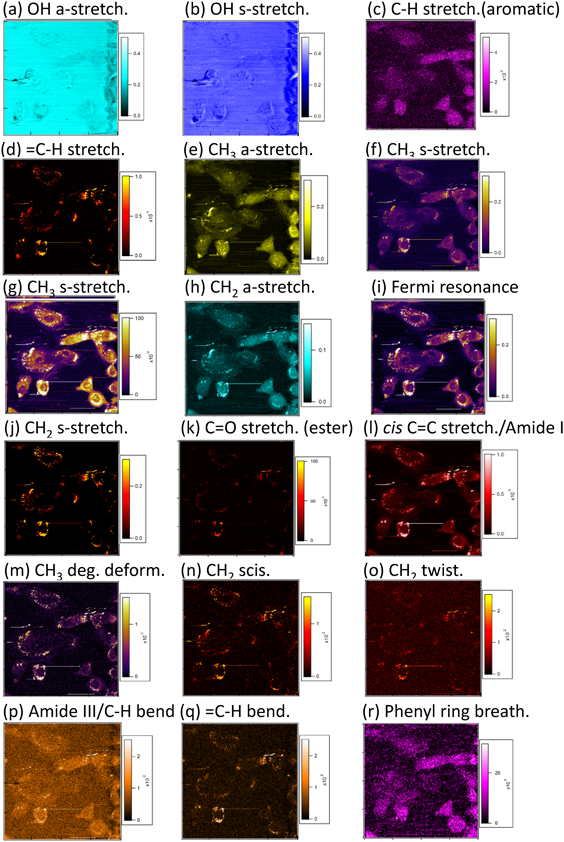
実測のCARASスペクトルは式(1)のように表されるため,振動共鳴成分とNRBとがスペクトル上で干渉している.そこで2節で述べたように,実測スペクトルをMEM40)によりχ(3)の虚部(Im[χ(3)])に復元したスペクトル(自発ラマン相当のスペクトル)を図4に示す.図3cの上段,下段のそれぞれのスペクトルが,図4の上段,下段のそれぞれへと変換されている.挿入図は上段,下段それぞれのスペクトルの指紋領域の拡大図である.これらのスペクトルはそれぞれ,細胞内脂質(上段)およびタンパク質(下段)の典型的なスペクトルとよく一致している.すなわち,3427, 3200, 3066, 3017, 2930, 2939, 2854, 1744, 1657, 1451, 1438, 1303, 1265,そして1009 cm−1の波数位置のバンドはそれぞれ,OH逆対称伸縮振動,OH対称伸縮振動,芳香環由来のCH伸縮振動,=C-H伸縮振動,CH3対称伸縮振動,CH2対称伸縮振動,C=O伸縮振動,アミドI(かつ/またはcis C=C伸縮振動),CH3縮重変角振動,CH2はさみ変角振動,CH2ひねり変角振動,そしてフェニル環の環呼吸振動に同定できる.表1に,振動バンドの波数位置と帰属等を示す32, 41).
表1 細胞内で典型的にみられる振動バンドの波数位置,帰属,主な分子種44–52)| 典型的なラマンシフト(cm−1) | 帰属 | 主な分子種 | 図5, 6の対応 |
|---|
| 3427 | OH逆対称伸縮振動(O-H a-stretch.) | 水 | a |
| 3200 | OH対称伸縮振動(O-H s-stretch.) | 水 | b |
| 3066 | 芳香環由来のCH伸縮振動(C-H stretch. (aromatic)) | タンパク質 | c |
| 3017 | =C-H伸縮振動(=C-H stretch.) | 脂質 | d |
| 2953 | CH3逆対称伸縮振動(CH3 a-stretch.) | DNAおよびRNA | e |
| ~2930 | CH3対称伸縮振動(CH3 s-stretch.) | タンパク質/脂質 | f, g |
| 2902 | CH2逆対称伸縮振動(CH2 a-stretch.) | 脂質/タンパク質 | h |
| 2872 | CH3縮重変角振動の倍音とCH3対称伸縮振動とのフェルミ共鳴(Overtone of CH3 deform. in Fermi resonance with CH3 s-stretch.) | タンパク質/脂質 | i |
| 2854 | CH2対称伸縮振動(CH2 s-stretch.) | 脂質 | j |
| 1744 | エステル結合由来のC=O伸縮振動(C=O stretch. (ester)) | 脂質 | k |
| 1657 | cis C=C伸縮振動/アミドI (cis C=C stretch./Amide I) | 脂質/タンパク質 | l |
| ~1550 | プリン環(アデニンおよびグアニン) | DNAおよびRNA | |
| 1451 | CH3縮重変角振動(CH3 deg. deform.) | タンパク質 | m |
| 1438 | CH2はさみ変角振動(CH2 scis.) | 脂質 | n |
| 1303 | CH2ひねり変角振動(CH2 twist.) | 脂質 | o |
| ~1284 | アミドIII/CH変角振動(Amide III/C-H bend.) | タンパク質 | p |
| 1265 | CH変角振動(=C-H bend.) | 脂質 | q |
| 1009 | フェニル環の環呼吸振動(Phenyl ring breath.) | タンパク質 | r |
図5の各波数でのCARSイメージでは,マイクロスコピックな種々の細胞内構造が可視化されている.たとえば直径数マイクロメートルの粒子状の構造物が図5d, j, k, n, o,およびqにて多数みられている.これらの振動モードはそれぞれ,不飽和結合由来のCH伸縮振動(=C-H)(d),CH2対称伸縮振動(j),そしてエステル結合由来のC=O伸縮振動(k),CH2はさみ(n),CH2ひねり(o),そして不飽和結合由来のCH変角振動(=C-H)(q)であり,すべて脂質において典型的にみられるバンド群である.したがって,これら粒子状の構造物は細胞内脂肪滴であると同定できる.また,図5dおよびqで示されているように,脂肪滴には不飽和脂質が豊富に含まれている.これらの結果はA549細胞の特徴(不飽和脂質を生合成する)と矛盾しない.一方,図5fおよびgのCARSイメージでは,細胞内に暗くて丸い構造物がある.これは細胞核に対応する.核内には,芳香環由来のCH伸縮振動(図5c)はじめ,複数のイメージ(図5e, f, g, i, m,およびr)において複数の輝点が観測されているが,これらは核小体と同定できる.HeLa細胞を測定した我々の以前の報告32)では,DNAおよびRNAに由来する複数のバンドも観測されたが,今回測定したA549株では,1550 cm−1付近に小さいバンドが観測された程度であった.これはおそらく今回の実験の信号対雑音比が悪かった,または細胞株依存性があるためであると考えられる.また,興味深いことに2902 cm−1のCARSイメージでは核膜が顕著なコントラストを示している.これはおそらくリン脂質に由来するCH2逆対称伸縮振動に帰属できると考えられる.一方,OH逆対称および対称伸縮振動に帰属できる3427および3200 cm−1のCARSイメージでは,培地,細胞内ともに含まれる水のためコントラストが視野全体にわたって低下している.このOH領域のスペクトルを詳細に解析することで,細胞内水の水素結合の度合いを評価できることを,最近我々は報告した42).
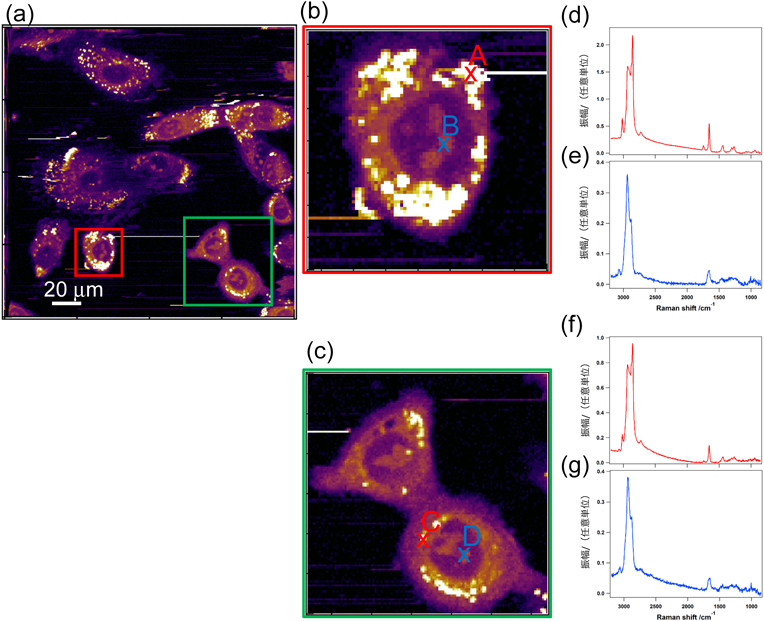
次に,生細胞の超広帯域ウルトラ・マルチプレックスCARS分光イメージングを行った結果を図6に示す.視野は200 µm2,全画素は401×401ピクセルであった.CCDカメラの読み出し時間を考慮に入れたところ,1ピクセルあたりの露光時間は1.8 msであった.これまでの我々の測定時間(50 ms32))と比べて,25倍以上速度が向上した.図5と同様に,各振動モードにて複数の生細胞が明瞭に可視化されている.図7には図6の一部を拡大した結果を示す.図7a(図6fと同一)の中の左および右四角枠を拡大した結果を図7bおよびcに,その中に示したA~D点のスペクトルを図7d~gに示す.スペクトルは2-µm2四方を空間平均した結果である.図7dおよびfは不飽和脂質に,図7eおよびgはタンパク質に同定できる.以上のように,露光時間1.8 msでも,十分なクオリティのIm[χ(3)]スペクトル(自発ラマン相当のスペクトル)を取得できることが示された.