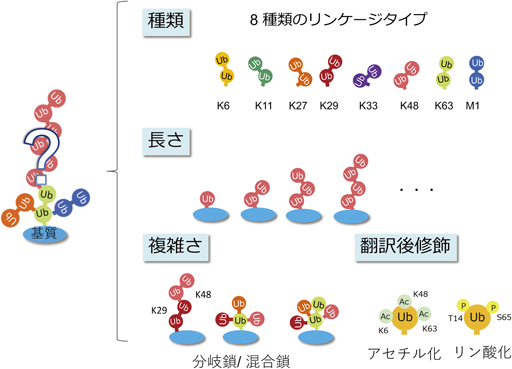
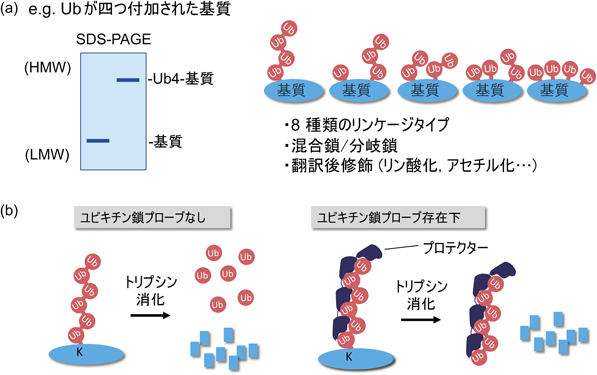
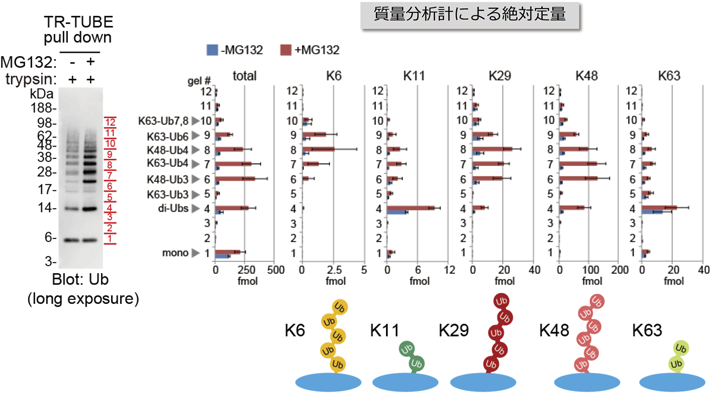
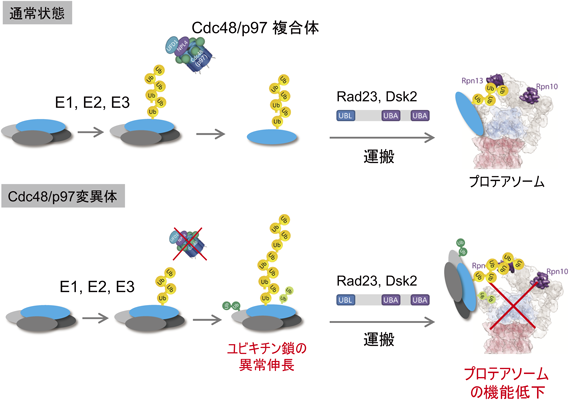
細胞内のユビキチン鎖長解析A novel method to determine the chain length of the polyubiquitinated proteins
東京都医学総合研究所蛋白質代謝研究室Laboratory of Protein Metabolism, Tokyo Metropolitan Institute of Medical Science ◇ 〒156–0506 東京都世田谷区上北沢2–1–6 ◇ 2–1–6 Kamikitazawa, Setagaya-ku, Tokyo 156–8506, Japan