タンパク質のユビキチン化は,当初,プロテアソーム分解へ導かれる翻訳後修飾として同定されたが,現在では,エンドサイトーシス,シグナル伝達,DNA修復など,非常に多彩な細胞機能制御に関連することが明らかになっている1).このような多彩な機能は,ユビキチンの連結様式の違いによって生み出される.通常,ユビキチン鎖はユビキチン分子内に7個存在するLys残基のいずれかのε-アミノ基と他のユビキチンのC末端Gly残基のカルボキシル基とのイソペプチド結合により形成される.しかしながら,本稿のトピックである直鎖状ユビキチン鎖は,ユビキチンのLys残基ではなくN末端のMet残基のα-アミノ基を介したペプチド結合で形成され2),HOIL-1L(heme-oxidized IRP2 ubiquitin ligase 1L),HOIP(HOIL-1L-interacting protein),SHARPIN(shank-associated RH domain-interacting protein)の3種のサブユニットから構成されるlinear ubiquitin chain assembly complex(LUBAC)ユビキチンリガーゼによって特異的に生成される(岩井らの稿を参照)3, 4).
LUBACは,TNF-α(腫瘍壊死因子-α)などの炎症性サイトカイン刺激に応答して,迅速にIκBキナーゼ(IKK)の制御サブユニットであるNEMO(NF-κB essential modulator)を直鎖状ポリユビキチン化する.これが引き金となってIKKの集積と活性化を引き起こし,IκBα(NF-κB inhibitor α)をプロテアソーム分解へ導くことで古典的NF-κBシグナルを惹起する3, 4).一方で,LUBACによる直鎖状ポリユビキチン鎖生成は細胞死を抑制し,胚発生において必須な機能を果たすとともに,制御性T細胞(regulatory T cell:Treg)でのLUBACの機能不全は重篤な皮膚炎病態を引き起こす5–8).加えて,抗がん剤であるシスプラチンへの耐性9)やマウス骨肉腫の肺転移10)をはじめ,各種がんと密接に連関することが知られる.中でも,直鎖状ユビキチン鎖生成とB細胞リンパ腫との関連性を示す報告が多く,当研究室でもNF-κBシグナルの抑制因子として知られる脱ユビキチン化酵素(A20)が7番目の亜鉛フィンガー領域(A20-ZF7)を介して直鎖状ユビキチン鎖に特異的に結合すること,また,非ホジキンリンパ腫を起こすA20の遺伝子変異によって直鎖状ユビキチン鎖への結合能やTNF受容体への会合親和性が低下し,その結果,NF-κBの過剰活性化が,がんを引き起こす可能性を報告した11).さらに,リンパ腫の中で最も頻度が高い非ホジキンリンパ腫である,びまん性大細胞型B細胞リンパ腫(diffuse large B-cell lymphoma:DLBCL)のうち,予後不良型として知られる活性化B細胞様DLBCL(activated B-cell like DLBCL:ABC-DLBCL)の増殖には,LUBACを介したNF-κB活性化が重要で,HOIPのSNPsが関連することが明らかになっている12, 13).
このように,NF-κBや細胞死シグナルの制御機構としての機能を背景に,直鎖状ユビキチン鎖はさまざまな疾患と関連することが報告され,新たな創薬ターゲットとしても注目されている.本稿では,近年報告され始めている神経変性疾患との関連性とLUBACに対する阻害剤開発の現状について,筆者らの研究を中心に国内外の動向を交えて紹介したい.
1)OPTN変異を伴うALSと直鎖状ユビキチン鎖
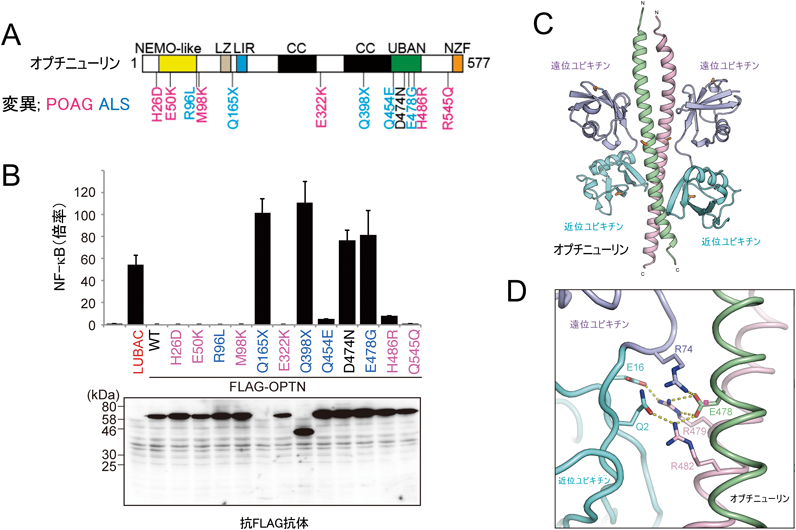
オプチニューリン(OPTN)はNEMOと同様,直鎖状ユビキチン鎖に特異的に結合するUBAN[ubiquitin binding in A20-binding IκB(ABIN)and NEMO proteins]ドメインを備え,NF-κBのみならず,オートファジーや細胞内輸送を制御する多機能性タンパク質である.OPTN遺伝子変異は原発開放隅角緑内障(primary open angle glaucoma:POAG)と筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)という神経変性疾患に関連することが報告されているが,なぜ二つの異なる疾患を引き起こすか,その発症機序は不明である14, 15).そこで筆者らは,それまで見いだされていたPOAG型OPTN変異体(6種)とALS型変異体(5種)を包括的に作製し(図1A),NF-κB活性制御や直鎖状ユビキチン鎖結合との連関を解析した.
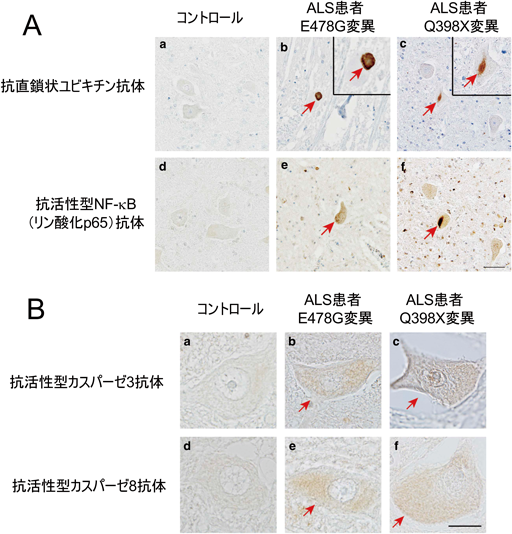
その結果,POAG型変異体は野生型と同様,強くNF-κB活性を抑制したが,ALS型変異体はNF-κB活性抑制能を喪失することがわかった(図1B)16).これらは主にUBANドメインの欠失やアミノ酸変異に起因しており,OPTN UBANドメインを介したNF-κB阻害活性能の喪失がALS発症に重要であると示唆された.実際,CRISPR/Cas9法によりOPTN遺伝子を破壊した細胞では,各種サイトカイン刺激に伴うNF-κB活性化が亢進するとともにアポトーシスが亢進した.これらは,野生型OPTNを入れ戻すことで回復したが,ALS型変異体のE478Gでは回復しなかった16).さらに,共結晶構造解析の結果,OPTN UBANドメインは二量体を形成し,その両側に直鎖状ユビキチンが特異的に結合すること(図1C),478番目のGlu残基は遠位ユビキチンの74番目のArg残基と水素結合を形成し,直鎖状ユビキチンとの結合に重要なアミノ酸残基であることが示された(図1D)16).また,OPTN遺伝子変異(Q398X, E478G変異)を伴うALS患者由来の脊髄運動ニューロンの免疫染色を行ったところ,直鎖状ユビキチン鎖や活性型NF-κB(リン酸化p65)が神経細胞質内封入体に染色され(図2A),アポトーシスの指標である活性型カスパーゼ3やカスパーゼ8の染色性も亢進しており(図2B),ALSにおいて円形あるいは糸くず様(スケイン様)封入体を形成するタンパク質として特徴的なリン酸化TDP-43(TAR DNA-binding protein-43)と共局在した.
ALSは運動ニューロンが選択的に侵される神経難病で,約90%は発症原因が不明な孤発性であるが,約10%は遺伝子変異が関連する家族性であり,これまでにOPTNを含めて約20の原因遺伝子が見いだされている.これらは,凝集体形成,タンパク質分解,神経炎症に関わると考えられているが,本研究からALS型変異に伴うOPTNの直鎖状ユビキチン鎖との結合能の喪失が神経炎症やアポトーシスの恒常的な亢進を惹起し,ALS発症や進展に寄与する可能性が示唆された16).
2)アルツハイマー病と直鎖状ユビキチン鎖
ALS以外にもアルツハイマー病,パーキンソン病,ハンチントン病などの神経変性疾患で共通して認められる病理所見として,ユビキチン陽性タンパク質封入体の形成があげられる.たとえば,アルツハイマー病患者の脳神経組織では,アミロイドβ(amyloid β:Aβ)の沈着(Aβ斑または老人斑)や,異常リン酸化されたタウタンパク質の凝集体である神経原線維変化(neurofibrillary tangle:NFT)が認められる.しかし,これらのユビキチン陽性封入体にどのようなタイプのユビキチン連結鎖が含まれるか,不明な点が多い.
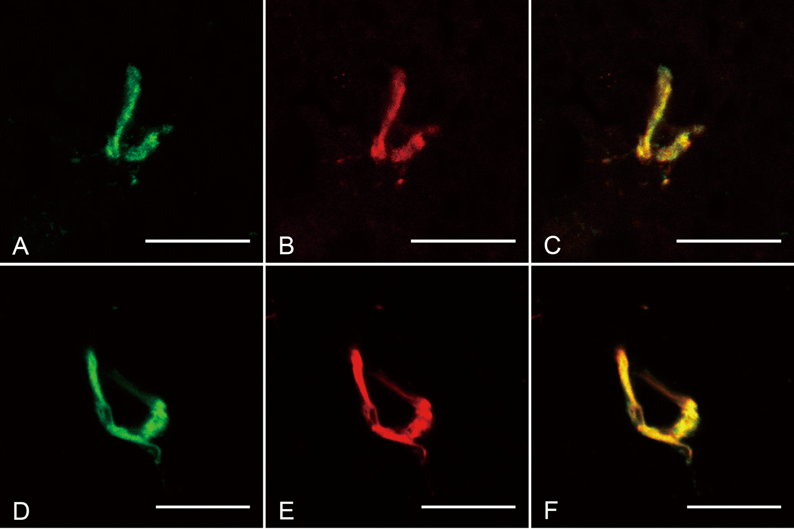
そこで我々は,免疫組織染色によって直鎖状ユビキチン鎖を認識可能な抗体(LUB6)を新たに作製し,アルツハイマー病患者由来の病理組織を用いた免疫組織化学解析を進めた17).その結果,海馬のNFTが,K48型ユビキチン鎖よりも数は少ないものの,直鎖状ユビキチン鎖陽性であった(図3)17).また,K48型と直鎖型の両方,あるいはK48型のみ陽性のNFTはみられたが,直鎖型のみを呈するNFTは認められなかったことから,アルツハイマー病患者の脳組織ではK48型ユビキチン鎖陽性封入体が先行して生成され,病態の進行とともに直鎖状ユビキチン鎖が加わった複雑な構成のユビキチン鎖を形成する可能性が示唆された17).
3)直鎖状ユビキチン鎖の凝集性とタンパク質凝集体形成
興味深いことに,タンパク質凝集体の形成は付加されるユビキチン鎖によっても大きな影響を受け,ユビキチン鎖長の増加とともに熱安定性が減少し,ユビキチン鎖単独でアミロイド様の凝集体線維を形成すること,また,K48型に比べて直鎖状ユビキチン鎖でその傾向が強いことが明らかになっている18, 19).さらに,GFPなどのモデル基質に人工的にユビキチン分子を一つ付加した場合は大きな変化は認められないものの,6分子の直鎖状ユビキチン鎖を付加することでモデルタンパク質のフォールディングが阻害され,熱変性とともにアミロイド様の凝集体線維を形成することを示している(森本らの稿を参照)18).これらの知見を合わせると,神経変性疾患でみられるタンパク質凝集体への直鎖状ユビキチン鎖の付加は,基質タンパク質を不安定化し,タンパク質凝集体形成を促進させるように思われる.
一方,Winklhoferらは,凝集体形成モデルとしてよく用いられるポリグルタミン鎖が伸長したハンチンチン(Htt-polyQ)を用いた解析から,LUBACがp97/VCP依存的にHtt-polyQにリクルートされ直鎖状ユビキチン鎖を付加し,プロテアソームによる分解を促進させる可能性を示している20).同様に,マシャド・ジョセフ病の凝集体タンパク質モデルであるAtaxin-3-Q84やALSモデルのSOD1(G85R変異体),TDP-43(Q331K変異体),OPTN(R96L変異体)でも,各凝集体へのLUBACのリクルートが示されている20).これらはいずれも細胞レベルでの解析結果だが,LUBACのタンパク質凝集体へのリクルートと直鎖状ユビキチン鎖の付加が,広い範囲の神経変性疾患病態で生じている可能性が考えられる.我々は,LUBACは本来,神経保護的な作用を持っているが,プロテアソーム分解できずK48ユビキチン化タンパク質が蓄積した場合は,これに直鎖状ユビキチン鎖を付加することでタンパク質の液・液相分離を促進するとともに神経炎症や細胞死の亢進,タンパク質分解阻害を引き起こし,神経変性疾患を増悪する“両刃の剣”となる可能性を推定している.
1)LUBAC阻害剤開発の現状
このように直鎖状ユビキチン鎖の過剰生成は,NF-κBシグナルや細胞死シグナルを制御し,B細胞リンパ腫などのがんや神経変性疾患に関連することから,LUBACは創薬ターゲットとしても注目されている.実際,これまでにLUBAC阻害剤としてBAY11-708221),グリオトキシン(gliotoxin)22),ベンダムスチン(bendamustine)23)などの低分子化合物が報告されている.最初に報告されたBAY11-7082はNF-κB阻害剤として炎症研究に用いられているが,いくつかのユビキチン結合酵素(E2)活性も抑制することから,LUBACに対する特異性に欠ける21).グリオトキシンも抗炎症作用を備え,NF-κB阻害剤として以前より知られていたが,LUBACの酵素活性中心であるHOIPのC末端領域に結合し,直鎖状ユビキチン鎖の生成を阻害するという作用機序の一端が明らかとなった22).グリオトキシンはTNF-αやシスプラチン依存的な細胞死を亢進させるものの,細胞毒性が高く特異性も低いことから,LUBAC阻害剤としての活用は難しい.また,悪性リンパ腫治療薬として知られるベンダムスチンがLUBAC活性を抑制することが報告されたが,in vitroでの解析しか行われておらず,細胞レベルでの機能性は不明である23).
最近,RittingerのグループはLUBAC阻害剤として各種α, β-不飽和メチルエステル含有化合物誘導体を作製し,in vitroでのLUBAC活性のみならず,細胞内でNF-κBルシフェラーゼレポーター活性を抑制する化合物を同定した24).さらに,X線共結晶構造解析から,これらの化合物がHOIPの活性中心であるCys885に結合することでRING/HECTハイブリッド反応を抑制することを示している24).
さらに,LUBACを標的としたステープルペプチド(化学架橋して二次構造を安定化した短鎖ペプチド)も開発されている.HOIPとHOIL-1L間の相互作用を阻害するステープルペプチドは,LUBAC活性を抑制し,ABC-DLBCLの増殖を抑制させることから,展開体の作製も進められている12, 25).また,岩井らのグループはHOIL-1LとSHARPIN間の相互作用を阻害するステープルペプチドを開発し,細胞内のLUBACタンパク質を減衰させるとともに,TNF-α刺激に伴うNF-κB活性化を抑制し,細胞死を亢進させることを報告している26).
2)LUBAC阻害剤,HOIPINsの同定と展開
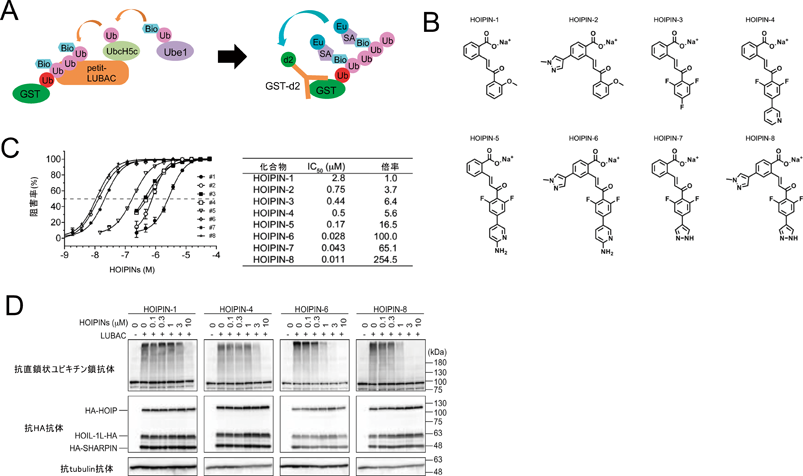
筆者らはJT(日本たばこ産業株式会社)との共同研究として,LUBACによる直鎖状ユビキチン鎖の生成をハイスループットに検出する手法を構築した27).時間分解蛍光(time resolved fluorescence:TRF)と蛍光共鳴エネルギー転移(fluorescence resonance energy transfer:FRET)を組み合わせて確立した本法(homogeneous time resolved fluorescence:HTRF)では,HOIPとHOIL-1Lの各部分断片からなるpetit-LUBACにより産生された直鎖状ユビキチン鎖を,Ub-GST(C末端にGSTを付加したユビキチン)とBio-Ub(ビオチン化したユビキチン)間のFRETにより検出し(図4A),petit-LUBACの濃度依存性や反応時間への依存性を評価できることを確認した27).次に本法を用いて,約25万個の化合物ライブラリーからLUBAC活性を阻害する新規化合物を探索し,in vitroにおいてIC50=2.8 µMで選択的にLUBACの活性を阻害する化合物として,sodium 2-[(1E)-3-(2-methoxyphenyl)-3-oxoprop-1-en-1-yl]benzoate(図4B, C)を見いだした.これをHOIPIN-1(HOIP inhibitor-1)と名づけ細胞レベルで薬効解析を進めたところ,確かにLUBAC過剰発現による直鎖状ユビキチン鎖の産生を抑制し(図4D),IL-1β刺激に伴うNF-κB活性化も抑制した27).
次に,より強い阻害活性を備える化合物を探索する目的で,HOIPIN-1を基に合成展開を行った.その結果,petit-LUBACに対してHOIPIN-1よりも強い阻害活性を示す化合物を七つ同定した(図4B, C)28).中でもHOIPIN-8[sodium(E)-2-(3-(2,6-difluoro-4-(1H-pyrazol-4-yl)phenyl)-3-oxoprop-1-en-1-yl)-4-(1-methyl-1H-pyrazol-4-yl)benzoate]は最も強い阻害活性を示し,HOIPIN-1に比べて約255倍(IC50=0.011 µM)強力に直鎖状ユビキチン鎖生成を阻害することが示された(図3C)28).HOIPIN-8は細胞レベルでもLUBAC発現に伴う細胞内直鎖状ユビキチン鎖量を低下させ(図4D),NF-κB活性化をIC50=0.4 µMで抑制する.さらにTNF-αやIL-1β刺激に伴うNF-κB活性化や標的遺伝子発現を顕著に抑制する28).したがって,現在のところHOIPIN-8はLUBAC阻害剤として最も強力な化合物といえる.HOIPIN-1やHOIPIN-8はα, β-不飽和カルボニル含有化合物でマイケル付加反応によってLUBAC分子内の重要なCysを修飾すると考えられ,現在,自然免疫応答や細胞死などの各種シグナル経路に対する影響や,各種疾患に対する抑制効果などを検証している.
このように,LUBACによるユビキチンのN末端を介した直鎖状ユビキチン鎖生成はNF-κB活性化を導き,炎症応答,自然・獲得免疫および細胞死を制御する.また,そのメカニズムの破綻は,がんや神経変性疾患など多くの疾患に関わることも明らかになってきた.したがって,LUBAC活性を標的とする化合物は,in vitroでの細胞機能解析の重要な研究ツールになるのみならず,疾患治療を見据えた創薬シーズとしても高く期待できる.モデル生物を用いた薬効解析には難点も多くあるが,ALSなどの有効な治療薬がない神経変性難病に対して一筋の光明をみることを願いつつ今後の研究を推進したい.
謝辞Acknowledgments
本稿で紹介したHOIPIN-1~8の開発は,日本たばこ産業株式会社の飯尾清誠博士,小比賀真吾博士,勝矢健博士,花田和希博士,坂本信二博士との共同研究として進められました.ここに深く感謝いたします.
引用文献References
1) Komander, D. & Rape, M. (2012) The ubiquitin code. Annu. Rev. Biochem., 81, 203–229.
2) Kirisako, T., Kamei, K., Murata, S., Kato, M., Fukumoto, H., Kanie, M., Sano, S., Tokunaga, F., Tanaka, K., & Iwai, K. (2006) A ubiquitin ligase complex assembles linear polyubiquitin chains. EMBO J., 25, 4877–4887.
3) Tokunaga, F., Sakata, S., Saeki, Y., Satomi, Y., Kirisako, T., Kamei, K., Nakagawa, T., Kato, M., Murata, S., Yamaoka, S., et al. (2009) Involvement of linear polyubiquitylation of NEMO in NF-κB activation. Nat. Cell Biol., 11, 123–132.
4) Tokunaga, F., Nakagawa, T., Nakahara, M., Saeki, Y., Taniguchi, M., Sakata, S., Tanaka, K., Nakano, H., & Iwai, K. (2011) SHARPIN is a component of the NF-κB-activating linear ubiquitin chain assembly complex. Nature, 471, 633–636.
5) Peltzer, N., Darding, M., Montinaro, A., Draber, P., Draberova, H., Kupka, S., Rieser, E., Fisher, A., Hutchinson, C., Taraborrelli, L., et al. (2018) LUBAC is essential for embryogenesis by preventing cell death and enabling haematopoiesis. Nature, 557, 112–117.
6) Taraborrelli, L., Peltzer, N., Montinaro, A., Kupka, S., Rieser, E., Hartwig, T., Sarr, A., Darding, M., Draber, P., Haas, T.L., et al. (2018) LUBAC prevents lethal dermatitis by inhibiting cell death induced by TNF, TRAIL and CD95L. Nat. Commun., 9, 3910.
7) Lafont, E., Draber, P., Rieser, E., Reichert, M., Kupka, S., de Miguel, D., Draberova, H., von Mässenhausen, A., Bhamra, A., Henderson, S., et al. (2018) TBK1 and IKKε prevent TNF-induced cell death by RIPK1 phosphorylation. Nat. Cell Biol., 20, 1389–1399.
8) Sasaki, K., Himeno, A., Nakagawa, T., Sasaki, Y., Kiyonari, H., & Iwai, K. (2019) Modulation of autoimmune pathogenesis by T cell-triggered inflammatory cell death. Nat. Commun., 10, 3878.
9) MacKay, C., Carroll, E., Ibrahim, A.F.M., Garg, A., Inman, G.J., Hay, R.T., & Alpi, A.F. (2014) E3 ubiquitin ligase HOIP attenuates apoptotic cell death induced by cisplatin. Cancer Res., 74, 2246–2257.
10) Tomonaga, M., Hashimoto, N., Tokunaga, F., Onishi, M., Myoui, A., Yoshikawa, H., & Iwai, K. (2012) Activation of nuclear factor-kappa B by linear ubiquitin chain assembly complex contributes to lung metastasis of osteosarcoma cells. Int. J. Oncol., 40, 409–417.
11) Tokunaga, F., Nishimasu, H., Ishitani, R., Goto, E., Noguchi, T., Mio, K., Kamei, K., Ma, A., Iwai, K., & Nureki, O. (2012) Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation. EMBO J., 31, 3856–3870.
12) Yang, Y., Schmitz, R., Mitala, J., Whiting, A., Xiao, W., Ceribelli, M., Wright, G.W., Zhao, H., Yang, Y., Xu, W., et al. (2014) Essential role of the linear ubiquitin chain assembly complex in lymphoma revealed by rare germline polymorphisms. Cancer Discov., 4, 480–493.
13) Dubois, S.M., Alexia, C., Wu, Y., Leclair, H.M., Leveau, C., Schol, E., Fest, T., Tarte, K., Chen, Z.J., Gavard, J., et al. (2014) A catalytic-independent role for the LUBAC in NF-κB activation upon antigen receptor engagement and in lymphoma cells. Blood, 123, 2199–2203.
14) Maruyama, H., Morino, H., Ito, H., Izumi, Y., Kato, H., Watanabe, Y., Kinoshita, Y., Kamada, M., Nodera, H., Suzuki, H., et al. (2010) Mutations of optineurin in amyotrophic lateral sclerosis. Nature, 465, 223–226.
15) Rezaie, T., Child, A., Hitchings, R., Brice, G., Miller, L., Coca-Prados, M., Héon, E., Krupin, T., Ritch, R., Kreutzer, D., et al. (2002) Adult-Onset Primary Open-Angle Glaucoma Caused by Mutations in Optineurin. Science, 295, 1077–1079.
16) Nakazawa, S., Oikawa, D., Ishii, R., Ayaki, T., Takahashi, H., Takeda, H., Ishitani, R., Kamei, K., Takeyoshi, I., Kawakami, H., et al. (2016) Linear ubiquitination is involved in the pathogenesis of optineurin-associated amyotrophic lateral sclerosis. Nat. Commun., 7, 12547.
17) Nakayama, Y., Sakamoto, S., Tsuji, K., Ayaki, T., Tokunaga, F., & Ito, H. (2019) Identification of linear polyubiquitin chain immunoreactivity in tau pathology of Alzheimer’s disease. Neurosci. Lett., 703, 53–57.
18) Morimoto, D., Walinda, E., Fukada, H., Sou, Y.S., Kageyama, S., Hoshino, M., Fujii, T., Tsuchiya, H., Saeki, Y., Arita, K., et al. (2015) The unexpected role of polyubiquitin chains in the formation of fibrillar aggregates. Nat. Commun., 6, 6116.
19) Morimoto, D., Walinda, E., Fukada, H., Sugase, K., & Shirakawa, M. (2016) Ubiquitylation Directly Induces Fold Destabilization of Proteins. Sci. Rep., 6, 39453.
20) van Well, E.M., Bader, V., Patra, M., Sánchez-Vicente, A., Meschede, J., Furthmann, N., Schnack, C., Blusch, A., Longworth, J., Petrasch-Parwez, E., et al. (2019) A protein quality control pathway regulated by linear ubiquitination. EMBO J., 38, e100730.
21) Strickson, S., Campbell, D.G., Emmerich, C.H., Knebel, A., Plater, L., Ritorto, M.S., Shpiro, N., & Cohen, P. (2013) The anti-inflammatory drug BAY 11-7082 suppresses the MyD88-dependent signalling network by targeting the ubiquitin system. Biochem. J., 451, 427–437.
22) Sakamoto, H., Egashira, S., Saito, N., Kirisako, T., Miller, S., Sasaki, Y., Matsumoto, T., Shimonishi, M., Komatsu, T., Terai, T., et al. (2015) Gliotoxin suppresses NF-κB activation by selectively inhibiting linear ubiquitin chain assembly complex (LUBAC). ACS Chem. Biol., 10, 675–681.
23) De Cesare, V., Johnson, C., Barlow, V., Hastie, J., Knebel, A., & Trost, M. (2018) The MALDI-TOF E2/E3 ligase assay as universal tool for drug discovery in the ubiquitin pathway. Cell Chem. Biol., 25, 1117–1127.
24) Johansson, H., Isabella Tsai, Y.C., Fantom, K., Chung, C.W., Kümper, S., Martino, L., Thomas, D.A., Eberl, H.C., Muelbaier, M., House, D., et al. (2019) Fragment-based covalent ligand screening enables rapid discovery of inhibitors for the RBR E3 ubiquitin ligase HOIP. J. Am. Chem. Soc., 141, 2703–2712.
25) Aguilar-Alonso, F., Whiting, A.L., Kim, Y.J., & Bernal, F. (2018) Biophysical and biological evaluation of optimized stapled peptide inhibitors of the linear ubiquitin chain assembly complex (LUBAC). Bioorg. Med. Chem., 26, 1179–1188.
26) Fujita, H., Tokunaga, A., Shimizu, S., Whiting, A.L., Aguilar-Alonso, F., Takagi, K., Walinda, E., Sasaki, Y., Shimokawa, T., Mizushima, T., et al. (2018) Cooperative domain formation by homologous motifs in HOIL-1L and SHARPIN plays a crucial role in LUBAC stabilization. Cell Rep., 23, 1192–1204.
27) Katsuya, K., Hori, Y., Oikawa, D., Yamamoto, T., Umetani, K., Urashima, T., Kinoshita, T., Ayukawa, K., Tokunaga, F., & Tamaru, M. (2018) High-throughput screening for Linear Ubiquitin Chain Assembly Complex (LUBAC) selective inhibitors using homogenous time-resolved fluorescence (HTRF)-based Assay System. SLAS Discov., 23, 1018–1029.
28) Katsuya, K., Oikawa, D., Iio, K., Obika, S., Hori, Y., Urashima, T., Ayukawa, K., & Tokunaga, F. (2019) Small-molecule inhibitors of linear ubiquitin chain assembly complex (LUBAC), HOIPINs, suppress NF-κB signaling. Biochem. Biophys. Res. Commun., 509, 700–706.
著者紹介Author Profile
 及川 大輔(おいかわ だいすけ)
及川 大輔(おいかわ だいすけ)大阪市立大学大学院医学研究科分子病態学講師.博士(バイオサイエンス).
略歴2002年弘前大学農学生命科学部卒業.07年奈良先端科学技術大学院大学バイオサイエンス研究科博士後期課程修了.日本学術振興会特別研究員(PD),群馬大学生体調節研究所研究員,助教などを経て16年より現職.
研究テーマと抱負非定型型ユビキチン鎖が担うシグナル伝達制御やその破綻に伴う疾患発症の分子機構の解明,及びユビキチンリガーゼや脱ユビキチン化酵素の特異的阻害剤開発を通じたユビキチン創薬に関する研究を展開.
ウェブサイトhttp://osaka-cu-1seika.umin.jp/
趣味スキューバダイビング(アシスタント資格を取得).
 伊東 秀文(いとう ひでふみ)
伊東 秀文(いとう ひでふみ)和歌山県立医科大学脳神経内科学講座教授,和歌山県立医科大学附属病院副院長.医学博士.
略歴1958年兵庫県に生る.84年京都大学医学部卒業.京都大学医学部附属病院,北野病院,アルバート・アインシュタイン医科大学モンテフィオーレ医学研究所,関西医科大学,京都大学を経て2012年より現職.
研究テーマと抱負難治性神経変性疾患の分子神経病理学的研究と分子標的治療の開発.
ウェブサイトhttp://www.wakayama-med.ac.jp/med/neurology/
趣味旅行.
 徳永 文稔(とくなが ふみのり)
徳永 文稔(とくなが ふみのり)大阪市立大学大学院医学研究科分子病態学教授.理学博士.
略歴1962年鹿児島県に生る.90年九州大学大学院医学系研究科博士課程修了.姫路工業大学,アルバート・アインシュタイン医科大学,大阪市立大学,大阪大学,群馬大学を経て2016年より現職.
研究テーマと抱負炎症応答や自然・獲得免疫を制御する新規ユビキチン修飾系因子の同定,生理機能解析,疾患との関連,および創薬を目指した化合物探索の推進.
ウェブサイトhttp://osaka-cu-1seika.umin.jp
趣味音楽(クラシック,オペラ,合唱).